Приложение
УТВЕРЖДЕНЫ
Постановлением
Главного государственного
санитарного врача
Российской Федерации
от 02 июня 2009 г. № 42
Дополнения и изменения № 1 к СП 1.3.2322-08
Санитарно-эпидемиологические правила
СП 1.3.2518-09
Внести дополнения и изменения в СП 1.3.2322-08:
1. В пункте 1.4.:
— дополнить абзац второй («III группа») следующим подпунктом: «- исследования по контролю объектов окружающей среды и качества продукции»;
— дополнить абзац третий («IV группа») следующим подпунктом:
«- ПЦР-исследования», а подпункт третий изложить в следующей редакции:
«- исследования по контролю объектов окружающей среды и качества продукции на наличие санитарно-показательных микроорганизмов»;
2. Пункт 2.1.1 изложить в следующей редакции: «Деятельность юридических лиц, независимо от организационно-правовых форм и форм собственности, и индивидуальных предпринимателей, связанная с использованием ПБА III-IV групп и возбудителями паразитарных болезней должна осуществляться в соответствии с Федеральным законом «О лицензировании отдельных видов деятельности» от 8 августа 2001 г. № 128-ФЗ (Собрание законодательства Российской Федерации, 2001, № 33 (часть I), ст.3430; 2002, № 11, ст.1020; 2002, № 50, ст.4925; 2003, № 2, ст.169; 2003, № 9, ст.805; 2003, № 11, ст. 956; 2003, № 13, ст.1178; 2003, № 52 (часть I), ст.5037; 2004, № 45, ст.4377; 2005, № 13, ст.1078; 2005, № 27, ст. 2719; 2006, № 1, ст.11; 2006, № 31 (1 ч.), ст.3455; 2006, № 50, ст.5279; 2007, № 1 (1ч.), ст.7; 2007, № 1 (1 ч.), ст.15; 2007, № 7, ст.834; 2007, № 30, ст.3748; 2007, № 30, ст. 3749; 2007, № 30, ст.3750; 2007, № 45, ст.5427; 2007, № 46, ст.5554; 2007, № 49, ст.6079; 2007, № 50, ст.6247; 2008, № 18, ст.1944; 2008, № 29 (ч.1), ст.3413; 2008, № 30 (ч.1), ст.3604; 2008, № 30 (ч.2), ст.3616; 2008, № 52, (ч.1), ст.6227; 2009, № 1, ст.15).
3. В пункте 2.1.2 абзац второй исключить.
4. В пункте 2.1.3 абзац третий дополнить и изложить в следующей редакции: «Хранение ПБА III — IV групп должно осуществляться в помещении «заразной» зоны. В отдельных случаях по согласованию с органами, осуществляющими государственный санитарно-эпидемиологический надзор, допускается их хранение в специально выделенном и оборудованном помещении «чистой» зоны, упакованными в соответствии с требованиями, предъявляемыми к транспортированию ПБА III — IV групп».
5. В пункте 2.1.6, в начале абзаца, исключить слово «Диагностические».
6. Пункт 2.2.3 изложить в следующей редакции:
«Инженерно-технический персонал, дезинфекторы и санитарки структурного
подразделения, осуществляющего деятельность с использованием ПБА III-IV
групп, должны проходить вводные и периодические инструктажи по
биологической безопасности по месту работы в соответствии с
должностными обязанностями. Допуск инженерно-технического персонала к обслуживанию оборудования оформляется на основании приказа руководителя организации один раз в два года».
7. В пункте 2.3.7 в третьем абзаце, в подпункте «- боксированные помещения с предбоксами или помещения, оснащенные боксами биологической безопасности», знак «двоеточие» (:) заменить на знак «точка с запятой»(;).
8. В пункте 2.3.7 в третьем абзаце, в подпункте «● для проведения бактериологических (вирусологических) исследований» и подпункте « ● для проведения иммунологических исследований» символ (●) заменить на «дефис» (-) и изложить подпункты в следующей редакции: «- помещения для проведения бактериологических (вирусологических) исследований;» и «- помещения для проведения иммунологических исследований;».
9. В пункте 2.3.7 в третьем абзаце, подпункт «- помещение для гельминтологических исследований» изложить в следующей редакции: «-помещение для паразитологических исследований».
10. Пункт 2.3.8 изложить в следующей редакции:
«На границе «чистой» и «заразной» зон, во вновь строящихся или реконструируемых лабораториях, должно предусматриваться устройство санитарных пропускников»
11. Пункт 2.3.9. изложить в следующей редакции: «В лабораториях, проводящих исследования с ПБА только IV группы, в «заразной» зоне должны располагаться:
— комната для посевов;
— комната для проведения исследований с ПБА;
— комната для обеззараживания и стерилизации.
— душевая в санитарном пропускнике на границе «чистой» и «заразной» зон;
Обязательна маркировка автоклавов, столов, стеллажей и разделение движения инфекционного и чистого материалов во времени».
12. В пункте 2.3.11 второй абзац изложить в следующей редакции: «В помещении «заразной» зоны не допускается устройство подвесных потолков, не отвечающих указанным требованиям, и подпольных каналов».
13. Пункт 2.3.24 изложить в следующей редакции: «Помещения блока для работы и содержания инфицированных животных, боксированные помещения, микробиологические комнаты, должны быть оборудованы автономными системами приточно-вытяжной вентиляции с механическим побуждением, оснащенными фильтрами тонкой очистки на выходе, проверяемыми на защитную эффективность, или боксами биологической безопасности II класса.
В отдельных случаях, для создания асептических условий в помещениях, фильтрами тонкой очистки могут оснащаться и приточные системы вентиляции».
14. Пункт 2.3.27. изложить в следующей редакции: «Для поддержания нормируемых параметров микроклимата могут быть установлены кондиционеры в рабочих комнатах и боксированных помещениях. На время работы с ПБА кондиционеры должны быть выключены. Фильтрующие элементы кондиционеров должны периодически (не реже 1 раза в 3 месяца) подвергаться очистке от механических частиц и дезинфекции. Не допускается установка кондиционеров в комнатах для содержания зараженных животных».
15. Пункт 2.3.31 дополнить новым абзацем: «Помещения для исследований на кишечные протозоозы и гельминтозы должны быть оборудованы вытяжным шкафом».
16. В пункт 2.4.1 внести следующее дополнение: после слов «…(марлевая салфетка, ткань, вата и пр.)» через запятую добавить «контейнеры, боксы или сумки-холодильники должны быть промаркированы и иметь международный знак «Биологическая опасность».
17. В пункт 2.4.16 внести следующее дополнение: после слова «емкостях» добавить «с соответствующей маркировкой».
18. Пункт 2.4.17 изложить в следующей редакции: «Пробирки и флаконы со сгустками крови обеззараживаются с использованием дезинфицирующих растворов или с применением физических методов дезинфекции с помощью оборудования, разрешенного для этих целей в установленном порядке. Вытряхивание необеззараженного сгустка крови из пробирки (флакона) запрещается. При погружении в дезинфицирующий раствор емкостей со сгустками крови необходимо соблюдать осторожность. Емкость берут анатомическим пинцетом так, чтобы одна его бранша вошла немного внутрь, и погружают ее в наклонном положении до полного заполнения раствором. При правильном погружении воздушные пузыри не образуются и емкость опускается на дно. После погружения всех емкостей пинцет обеззараживают».
19. В пункте 2.11.4 ссылку на пункт 2.10.3 заменить ссылкой на пункт 2.11.3.
20. В пункте 2.12.1 первый абзац изложить в следующей редакции: «Дезинфекцию различных объектов при работе с ПБА III — IV групп патогенности осуществляют физическим (кипячение, водяной насыщенный пар под избыточным давлением, сухой горячий воздух, УФ-облучение), химическим (использование растворов дезинфицирующих средств) и биологическими (биологические овициды) методами».
21. В пункте 2.12.1 начало второго абзаца изложить в следующей редакции: «Для дезинфекции допускается использование только дезинфицирующих средств и дезинвазионных (биологических овицидов) средств и оборудования», далее по тексту.
22. Пункт 2.12.3. изложить в следующей редакции:
«Дезинфекцию с использованием физического метода выполняют:
— паровым методом (в паровом стерилизаторе);
— воздушным методом (в воздушном стерилизаторе);
— паровоздушным методом (в дезинфекционной камере);
— УФ-облучением;
— токами сверхвысокой частоты (СВЧ) (для отходов).
Допускается кипячение в воде или в воде с добавлением натрия
двууглекислого (сода пищевая) в дезинфекционном кипятильнике».
23. В главе 3 пункту 3.7 присвоить порядковый номер 3.8, а порядковый номер 3.7 присвоить дополнительно вносимому пункту следующего содержания: «После ликвидации аварии руководитель организации совместно с членами Комиссии по контролю соблюдения требований биологической безопасности оценивают объем и качество, в том числе с использованием лабораторных методов исследований, проведенных мероприятий по локализации или ликвидации аварии и принимают решение о возобновлении работ с микроорганизмами».
24. В пункте 4.1 после слов «территориальные органы Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека» через запятую добавить «учреждения и структурные подразделения федеральных органов исполнительной власти, осуществляющих государственный санитарно-эпидемиологический надзор на объектах обороны и иного специального назначения».
При полном или частичном копировании информационного материала ссылка на сайт Управления Роспотребнадзора по Волгоградской области обязательна: http://34.rospotrebnadzor.ru/
Эпидемиология. Организация работы при исследованиях методом ПЦР материала, инфицированного патогенными биологическими агентами III-IV групп патогенности
УТВЕРЖДАЮ
Главный государственный
санитарный врач
Российской Федерации,
Первый заместитель
Министра здравоохранения
Российской Федерации
Г.Г.ОНИЩЕНКО
4 марта 2004 года
Дата введения:
с момента утверждения
ЭПИДЕМИОЛОГИЯ.
ОРГАНИЗАЦИЯ РАБОТЫ ПРИ ИССЛЕДОВАНИЯХ МЕТОДОМ ПЦР МАТЕРИАЛА, ИНФИЦИРОВАННОГО ПАТОГЕННЫМИ БИОЛОГИЧЕСКИМИ АГЕНТАМИ III-IV ГРУПП ПАТОГЕННОСТИ
Методические указания
МУ 1.3.1888-04
Оглавление
1. Область применения.
2. Нормативные ссылки.
3. Общие положения.
4. Требования к организации работы с ПБА III-IV групп патогенности методом ПЦР.
5. Требования к проведению работ.
6. Требования к обработке помещений и обеззараживанию материала.
7. Действия при возникновении контаминации лаборатории нуклеиновыми кислотами.
8. Оценка и контроль качества работы ПЦР-лаборатории.
Приложение 1. Термины, определения и сокращения.
Приложение 2. Перечень оборудования ПЦР-лаборатории.
Приложение 3. Действия при контаминации лаборатории нуклеиновыми кислотами.
1. Разработаны: Федеральным центром госсанэпиднадзора Минздрава России (Е.Н.Беляев, И.В.Брагина, С.Г.Домнин, М.В.Зароченцев, Э.Ф.Опочинский, Т.В.Воронцова), Центром по генной диагностике особо опасных инфекционных заболеваний Минздрава России на базе Российского научно-исследовательского противочумного института «Микроб» (А.Н.Куличенко, Н.А.Осина, И.Н.Шарова, М.Н.Ляпин, И.Г.Дроздов, В.В.Кутырев), Противочумным центром Минздрава России (В.Е.Безсмертный, С.М.Иванова, Ю.А.Панин), ООО «Биоком» (А.В.Сычев, А.Б.Комаров, Л.А.Сердобинский).
2. Утверждены и введены в действие Главным государственным санитарным врачом Российской Федерации — Первым заместителем Министра здравоохранения Российской Федерации Г.Г.Онищенко 4 марта 2004 г.
3. С введением настоящих Методических указаний теряют силу «Методические рекомендации по проведению работ в диагностических лабораториях, использующих метод полимеразной цепной реакции. Основные положения», утвержденные заместителем Председателя Госкомсанэпиднадзора Г.Г.Онищенко 22.06.95.
1. Область применения
1.1. Настоящие Методические указания устанавливают требования к помещениям лабораторий и порядку проведения в них работ с патогенными биологическими агентами (ПБА) III-IV групп патогенности с использованием методов, основанных на полимеразной цепной реакции (ПЦР).
1.2. Методические указания регламентируют выполнение исследований методом ПЦР с применением оборудования и тест-систем, разрешенных к применению на территории Российской Федерации в установленном порядке.
1.3. Методические указания определяют принципы организации работы лабораторий, использующих метод полимеразной цепной реакции, на этапах выполнения ПЦР-анализа.
2. Нормативные ссылки
2.1. СП 1.2.731-99 «Безопасность работы с микроорганизмами III-IV групп патогенности и гельминтами». Минздрав России, 1999.
2.2. СП 1.2.1318-03 «Порядок выдачи санитарно-эпидемиологического заключения о возможности проведения работ с возбудителями инфекционных заболеваний человека I-IV групп патогенности (опасности), генно-инженерно-модифицированными микроорганизмами, ядами биологического происхождения и гельминтами». Минздрав России, 2003.
2.3. СП 1.2.036-95 «Порядок учета, хранения, передачи и транспортирования микроорганизмов I-IV групп патогенности». Госкомсанэпиднадзор России, 1995.
2.4. МУ 1.3.1794-03 «Организация работы при исследованиях методом ПЦР материала, инфицированного микроорганизмами I-II групп патогенности». Минздрав России, 2003.
2.5. МУ 3.5.5.1034-01 «Обеззараживание исследуемого материала, инфицированного бактериями I-IV групп патогенности при работе методом ПЦР». Минздрав России, 2001.
2.6. «Методические указания по применению бактерицидных ламп для обеззараживания воздуха и поверхностей в помещениях» N 11-16/03-06 от 28.02.95. Минздравмедпром России, 1995.
3. Общие положения
3.1. Полимеразная цепная реакция представляет собой процесс многократного увеличения числа копий (амплификация) фрагмента ДНК-мишени (кДНК), катализируемый in vitro термостабильной ДНК-полимеразой, и позволяет обнаружить специфичный участок генома биологического агента.
3.2. ПЦР обладает высокой чувствительностью, специфичностью, обеспечивает возможность работы практически с любым видом биологического материала и объектами окружающей среды, позволяет выполнять анализ в течение 4-8 ч. Аналитическая чувствительность тест-систем для выявления ДНК (РНК) микроорганизмов методом ПЦР составляет 1 x 102 — 1 x 104 м.к. (геномэквивалент/мл), специфичность — 85-100%.
3.3. По результатам анализа выдают предварительный ответ о наличии в пробе специфических участков (фрагментов) ДНК или РНК, имеющих гомологию с определенным участком генома возбудителя того или иного инфекционного заболевания, а также о наличии в исследуемом материале генетических маркеров или генетически модифицированных ДНК.
3.4. Проведение исследований методом ПЦР сопряжено с необходимостью обеспечения соблюдения правил биологической безопасности, а также определенных требований к организации и проведению анализа с целью предотвращения контаминации исследуемых проб нуклеиновыми кислотами и получения ложноположительных и ложноотрицательных результатов.
4. Требования к организации работы с ПБА III-IV групп патогенности методом ПЦР
4.1. Общие требования
4.1.1. Работу с ПБА III-IV групп патогенности методом ПЦР проводят только при наличии в организации лицензии на деятельность, связанную с использованием возбудителей инфекционных заболеваний человека и санитарно-эпидемиологического заключения о возможности проведения соответствующих работ в лаборатории, выданных в установленном порядке.
4.1.2. Организацию работ на этапах приема, разбора и первичной обработки материала, подготовки проб и выделения нуклеиновых кислот, а также обеззараживания проб проводят в соответствии с требованиями СП 1.2.731-99 «Безопасность работы с микроорганизмами III-IV групп патогенности и гельминтами». Работу на остальных этапах ПЦР-анализа проводят как с обеззараженным материалом.
4.1.3. В лабораториях, имеющих санитарно-эпидемиологическое заключение о возможности проведения работ с ПБА III группы патогенности, допускается проведение исследований методом ПЦР (без предварительного накопления возбудителя) с целью диагностики бруцеллеза, парентеральных вирусных гепатитов, ВИЧ-инфекции, возбудители которых относятся ко II группе патогенности.
4.2. Требования к помещениям ПЦР-лаборатории
4.2.1. Помещения ПЦР-лаборатории, проводящей работы с ПБА III-IV групп патогенности, должны соответствовать требованиям СП 1.2.731-99 «Безопасность работы с микроорганизмами III-IV групп патогенности и гельминтами».
4.2.2. Проведение исследований методом ПЦР с ПБА III-IV групп патогенности допускается на базе действующих микробиологических (бактериологических, вирусологических, иммунологических и др.) лабораторий при условии соблюдения требований СП 1.2.731-99 «Безопасность работы с микроорганизмами III-IV групп патогенности и гельминтами» и организации в лаборатории самостоятельных или выделенных в составе других функциональных помещений рабочих зон, соответствующих этапам ПЦР-анализа.
4.2.3. ПЦР-лаборатория должна включать следующий минимальный набор рабочих зон:
— приема, регистрации, разбора и первичной обработки материала;
— выделения НК;
— приготовления реакционных смесей и проведения ПЦР;
— детекции продуктов амплификации методом электрофореза или ГиФА.
4.2.4. В ПЦР-лабораториях необходимо также предусмотреть наличие вспомогательных помещений (комнаты ведения учетных документов или ординаторской (комнаты персонала) <*>; кабинета заведующего лабораторией <*>; раздевалки для сотрудников <**>; комнаты приема пищи <**>; туалета <**>; подсобных (складских) помещений <**>).
————————————
<*> Помещения могут быть объединены.
<**> Помещения могут быть общими с другими подразделениями учреждения.
4.2.5. Необходимо наличие автоклавной комнаты для обеззараживания исследуемого материала. Она может быть общей с другими подразделениями учреждения при условии соблюдения требований биологической безопасности.
4.2.6. Помещения для выполнения работ на этапах ПЦР-анализа должны быть боксированными (боксы с предбоксами).
4.2.7. В зоне приема, регистрации, разбора и первичной обработки материала проводят прием ПБА, пробоподготовку (сортировку, маркировку, центрифугирование и др.), хранение и первичную инактивацию остатков биоматериала дезинфицирующими средствами. Зону приема, регистрации, разбора и первичной обработки материала располагают в комнате приема материала или в отдельном боксированном помещении. Здесь же можно проводить прием и обработку проб для исследования другими методами (бактериологическими, вирусологическими, иммунологическими и т.д.), при условии выделения отдельного оборудованного рабочего места для ПЦР-анализа.
4.2.8. Зону выделения нуклеиновых кислот размещают в отдельном помещении. При организации ПЦР-лаборатории на базе действующей микробиологической лаборатории допускается выделение НК в помещениях, в которых проводят другие виды исследований, кроме генно-инженерных работ и работ по накоплению ПБА. В этом случае в помещении организуют рабочую зону для выделения нуклеиновых кислот (НК), в которой располагают ПЦР-бокс или бокс биологической безопасности. В ПЦР-боксе (или боксе биологической безопасности) для выделения НК не допускается проведение других работ.
4.2.9. В зоне приготовления реакционных смесей и проведения ПЦР производят приготовление ПЦР-смеси, внесение в пробирку для ПЦР выделенных препаратов ДНК или кДНК, обратную транскрипцию РНК и амплификацию ДНК или кДНК. Помещение для приготовления реакционных смесей и проведения ПЦР должно быть отдельным. Приготовление реакционных ПЦР-смесей проводят в ПЦР-боксе.
4.2.10. При необходимости этап выделения НК может быть совмещен в одном помещении с этапом приготовления реакционных смесей и проведения ПЦР при наличии в нем отдельных ПЦР-боксов (боксов биологической безопасности) — для подготовки реакционных ПЦР-смесей и для выделения НК.
4.2.11. Зону детекции продуктов амплификации располагают в отдельном помещении, по возможности оснащенном ПЦР-боксом.
4.2.12. При необходимости одновременного использования для детекции продуктов амплификации метода электрофореза и метода гибридизационного анализа следует выделить в помещении детекции отдельную рабочую зону для проведения гибридизационного анализа. В этом случае оборудование и принадлежности для каждого вида детекции маркируют применительно к каждой зоне. Не допускается использовать для проведения гибридизационного анализа пипетки и посуду, предназначенные для электрофореза.
4.2.13. Планировочные решения и размещение оборудования должны обеспечивать поточность движения исследуемого материала. Следует полностью исключить воздухообмен между помещением детекции продуктов амплификации и другими помещениями.
4.2.14. Лабораторию оборудуют водопроводом, канализацией, электричеством и отоплением в соответствии с СП 1.2.731-99 «Безопасность работы с микроорганизмами III-IV групп патогенности и гельминтами». Все помещения лаборатории обеспечивают достаточным естественным и искусственным освещением.
4.2.15. При строительстве новых или реконструкции имеющихся ПЦР-лабораторий помещения оборудуют приточно-вытяжной или вытяжной вентиляцией. Разница в давлении воздуха в помещениях ПЦР-лаборатории достигается за счет различий в кратности воздухообмена в них. Кратность воздухообмена должна соответствовать значениям, приведенным в таблице.
|
Наименование помещения |
Кратность воздухообмена (куб. м/ч) |
|
|
приток |
вытяжка |
|
|
Зона приема, регистрации, разбора и первичной обработки материала |
5 |
6 |
|
Зона выделения нуклеиновых кислот (НК) |
5 |
6 |
|
Зона приготовления реакционных смесей и проведения ПЦР |
5 |
5 |
|
Зона детекции продуктов амплификации |
5 |
7 |
4.2.16. При необходимости в ПЦР-лаборатории могут быть установлены кондиционеры в соответствии с СП 1.2.731-99 «Безопасность работы с микроорганизмами III-IV групп патогенности и гельминтами».
4.2.17. Внутреннюю отделку помещений выполняют в соответствии с их функциональным назначением. Поверхности стен, пола и потолка в лабораторных помещениях должны быть гладкими, без щелей, легко обрабатываемыми, устойчивыми к действию моющих и дезинфицирующих средств. Полы не должны быть скользкими.
4.2.18. Лабораторная мебель должна иметь покрытие, устойчивое к действию моющих и дезинфицирующих средств. Поверхность столов не должна иметь трещин и швов.
4.2.19. Помещения на всех этапах ПЦР-анализа оборудуют бактерицидными лампами в соответствии с «Методическими указаниями по применению бактерицидных ламп для обеззараживания воздуха и поверхностей в помещениях» N 11-16/03-06 от 28.02.95. Бактерицидные лампы в помещениях ПЦР-лаборатории устанавливают из расчета 2,5 Вт/куб. м.
4.2.20. Помещения лаборатории должны быть непроницаемы для грызунов и насекомых.
4.2.21. ПЦР-лабораторию обеспечивают средствами пожаротушения.
4.3. Требования к лабораторному оборудованию
4.3.1. Комплект лабораторного оборудования определяют с учетом используемых наборов реагентов для выделения ПК, амплификации и детекции результатов исследований. Помещение для каждого этапа проведения ПЦР обеспечивают своим набором лабораторного оборудования (Прилож. 2).
4.3.2. Приборы, оборудование и средства измерения, используемые в работе лаборатории, должны быть технически исправны, иметь технический паспорт и рабочую инструкцию по эксплуатации. Средства измерения регулярно подвергают метрологическому контролю. Используемые приборы должны соответствовать нормам безопасности и электромагнитной совместимости.
4.3.3. Для проведения исследования используют приборы и расходные материалы (пробирки, наконечники к микродозаторам), исключающие возможность перекрестной контаминации исходного материала, выделенных НК и продуктов ПЦР. Для этого используют:
— термостаты с твердотельным термоблоком;
— пробирки с плотно закрывающимися крышками;
— одноразовые пробирки и наконечники к микродозаторам;
— наконечники, строго соответствующие автоматическим пипеткам, а пробирки для амплификации — термоциклерам (в соответствии с инструкцией фирмы — производителя прибора), смена наконечников после завершения каждой манипуляции является обязательной;
— специальные контейнеры для сброса использованных наконечников и пробирок, устанавливаемые на рабочих местах.
4.3.4. Микродозаторы, рабочая поверхность и наружная поверхность корпуса приборов должны быть устойчивы к действию моющих и дезинфицирующих средств и ультрафиолетового излучения.
4.3.5. Для каждого этапа проведения ПЦР-исследований необходимо предусмотреть наличие холодильников (Прилож. 2):
— в комнате приема материала от 4 до 8 град. С, минус 20 град. С (для хранения исследуемых проб);
— в комнате выделения НК от 4 до 8 град. С и минус 20 град. С — для хранения набора выделения НК; от 4 до 8 град. С — для хранения препаратов НК; не допускается хранение препаратов НК в одном холодильнике с компонентами набора для выделения НК;
— в комнате ПЦР-амплификации от 4 до 8 град. С и минус 20 град. С — для хранения наборов обратной транскрипции и амплификации НК;
— в комнате детекции продуктов амплификации от 4 до 8 град. С — для хранения наборов электрофоретической детекции и ГиФА.
5. Требования к проведению работ
5.1. Не допускается проведение исследований методом ПЦР в помещениях, где осуществляют работы по накоплению ПБА и генно-инженерные работы.
5.2. Работу с ПБА методом ПЦР выполняют специалисты с высшим и средним специальным образованием, прошедшие подготовку на лицензированных курсах специализации (повышения квалификации) по молекулярно-генетическим (ПЦР) методам диагностики.
5.3. Персонал допускают к работе с ПБА только после проведения инструктажа по соблюдению требований биологической безопасности.
5.4. В ПЦР-лаборатории, выполняющей работы с ПБА, используют дезинфицирующие средства, разрешенные к применению в установленном порядке.
5.5. Каждое помещение для проведения исследований методом ПЦР оснащают индивидуальным набором соответствующего лабораторного оборудования, расходных материалов и одежды, используемых только в данном помещении.
5.6. При проведении исследований методом ПЦР неукоснительно соблюдают следующие правила последовательной обработки материала:
5.6.1. Весь поступающий материал направляют в комнату приема материала.
5.6.2. Поступивший материал маркируют и регистрируют в специальном журнале.
5.6.3. Первичную обработку материала (взятие, маркировка и центрифугирование проб и др.) проводят только в комнате приема биологического материала.
5.6.4. В помещение выделения НК материал доставляют только в закрытых одноразовых пробирках в виде маркированных аликвот.
5.6.5. Передачу и доставку аликвот проб обработанного и обеззараженного материала, а также пробирок с продуктами ПЦР из одного помещения в другое осуществляют в закрывающихся металлических или пластмассовых контейнерах.
5.6.6. После проведения детекции и учета результатов исследования пробирки с продуктами ПЦР и использованные наконечники к микродозаторам подвергают первичной обработке дезинфицирующими растворами, вызывающими деградацию ДНК (например, 0,2%-ный раствор ДП-2Т или другие аналогичные ему, разрешенные к применению для этих целей в установленном порядке). Процедуру проводят непосредственно в комнате учета результатов амплификации.
5.6.7. Окончательную дезактивацию использованных расходных материалов и реагентов (гель, буфер для электрофореза) производят в автоклавной комнате.
5.6.8. Соблюдают поточность продвижения исследуемого материала и его производных (пробы ДНК или РНК, продукты ПЦР).
5.7. Строго соблюдают условия хранения всех реагентов и образцов ДНК согласно инструкции к набору реагентов. Образцы ДНК хранят отдельно от реагентов. Не допускается использование реагентов с истекшим сроком годности или хранившихся в условиях, не соответствующих требованиям, изложенным в инструкциях.
5.8. По окончании работы все объекты, содержащие ПБА, убирают в хранилища (холодильники, шкафы и т.д.), после чего рабочие поверхности в обязательном порядке подвергаются дезинфекции.
5.9. Остатки ПБА и посуду, использованную на этапах приема, разбора и первичной обработки материала, подготовки проб и выделения нуклеиновых кислот, приготовления реакционных смесей и проведения ПЦР, собирают в закрывающиеся емкости и передают в автоклавную. Слив необеззараженных жидкостей в канализационную сеть не допускается.
5.10. Перенос ПБА и использованной посуды для обеззараживания осуществляют в закрывающихся емкостях, исключающих инфицирование во время транспортирования.
5.11. Во всех помещениях лаборатории регулярно проводят влажную уборку. Каждую рабочую зону ПЦР-анализа обеспечивают индивидуальным промаркированным набором уборочного инвентаря. Не допускается использовать уборочный инвентарь для уборки других помещений.
5.12. Сотрудников каждой рабочей зоны обеспечивают спецодеждой: медицинским халатом, шапочкой, перчатками и сменной обувью. При работе в помещении детекции продуктов амплификации следует надевать бахилы. Перемещение одежды из зоны в зону категорически не допускается. Рекомендуется использование одноразовой одежды. Обработку рабочей одежды из зоны детекции продуктов амплификации проводят отдельно от одежды из других зон. Обеззараживание рабочей одежды проводят в соответствии с СП 1.2.731-99 «Безопасность работы с микроорганизмами III-IV групп патогенности и гельминтами».
5.13. Лабораторию обеспечивают аптечкой стандартной комплектации для оказания первой медицинской помощи.
6. Требования к обработке помещений и обеззараживанию материала
6.1. Обработку помещений проводят в соответствии с требованиями СП 1.2.731-99 «Безопасность работы с микроорганизмами III-IV групп патогенности и гельминтами». В комнатах, в которых проводят работу с выделенными НК, рабочие поверхности, штативы, оборудование следует обеззараживать ежедневно ультрафиолетовым излучением в течение 1 ч. Полы ежедневно подвергают влажной уборке с применением дезинфицирующих средств, регламентированных санитарными правилами. Перед началом работы рабочую поверхность столов дополнительно обрабатывают 70%-ным этиловым спиртом. Ежемесячно проводят профилактическую обработку рабочей поверхности столов и штативов 1 N соляной кислотой.
6.2. Обеззараживание проб проводят в соответствии с МУ 3.5.5.1034-01 «Обеззараживание исследуемого материала, инфицированного бактериями I-IV групп патогенности, при работе методом ПЦР».
7. Действия при возникновении контаминации лаборатории нуклеиновыми кислотами
7.1. При возникновении контаминации лаборатории проводят следующие мероприятия (Прилож. 3):
— утилизацию всех находящихся в «контаминированной» зоне реактивов;
— утилизацию исследуемых материалов на всех промежуточных стадиях обработки (кроме исходной);
— генеральную уборку, химическую и ультрафиолетовую дезинфекцию всех поверхностей лабораторных помещений;
— дезинфекцию мебели, рабочих поверхностей, а также поверхностей корпусов приборов и оборудования химическим методом и ультрафиолетовым излучением;
— обработку паром под давлением всей спецодежды «контаминированной» зоны.
7.2. Случаи контаминации регистрируют в специальном журнале с указанием мероприятий по ее устранению и результатов внутрилабораторного контроля.
7.3. Проведение ПЦР-исследований до завершения деконтаминационных мероприятий не допускается.
8. Оценка и контроль качества работы ПЦР-лаборатории
8.1. В ПЦР-лаборатории, проводящей работы с ПБА III-IV групп патогенности, проводят внутрилабораторный контроль качества дезинфекции, исследование смывов с рабочих поверхностей и воздушной среды боксов.
8.2. В ПЦР-лаборатории проводят внутрилабораторный контроль качества ПЦР-исследований. ПЦР-лаборатория принимает участие во внешнелабораторном контроле качества деятельности генодиагностических лабораторий.
8.3. Внутрилабораторный контроль проводят с периодичностью, зависящей от объема выполняемой работы и определяемой руководителем лаборатории, но не реже одного раза в квартал.
8.4. Контроль осуществляют путем исследования шифрованных аттестованных контрольных панелей, содержащих «положительные» и «отрицательные» пробы.
8.5. Количество проб зависит от объема проводимых исследований и должно быть достаточным для оценки работы сотрудников и выявления контаминированных участков лаборатории.
8.6. Для выявления возможной контаминации лаборатории нуклеиновыми кислотами контроль проводят путем взятия смывов с поверхностей. Смывы с поверхностей берут стерильными ватными тампонами (зондами). Перед взятием смывов тампоны (зонды) смачивают стерильным физиологическим раствором или ТЕ-буфером (10 mM Tris, 1 mM ЭДТА), после чего вращательными движениями протирают рабочие поверхности. После взятия смыва зонд помещают в микропробирки типа «эппендорф» с 300-400 мкл ТЕ-буфера, вращают в течение 10-15 с, избегая разбрызгивания раствора, и, отжав избыток жидкости о стенки пробирки, удаляют.
Полученные суспензии центрифугируют при 8000 g (12000 об./мин.) в течение 1 мин. Надосадочную жидкость отбирают наконечником с аэрозольным барьером в микропробирку объемом 1,5 мл. Для выделения НК используют 0,1-0,2 мл надосадочной фракции.
8.7. В качестве критериев оценки качества исследований методом полимеразной цепной реакции в лаборатории учитывают результаты внутреннего и внешнего лабораторного контроля, а также отсутствие случаев лабораторной контаминации нуклеиновыми кислотами.
Приложение N 1
(справочное)
ТЕРМИНЫ, ОПРЕДЕЛЕНИЯ И СОКРАЩЕНИЯ
Патогенные биологические агенты (ПБА) — патогенные для человека микроорганизмы (бактерии, вирусы, хламидии, риккетсии, простейшие, грибы, микоплазмы), генно-инженерно-модифицированные микроорганизмы, яды биологического происхождения (токсины), гельминты, а также любые объекты и материалы (включая полевой, клинический, секционный), подозрительные на содержание перечисленных агентов.
Биологическая безопасность — система организационных, медико-биологических и инженерно-технических мероприятий и средств, направленных на защиту работающего персонала, населения и среды обитания человека от воздействия патогенных биологических агентов.
НК — нуклеиновые кислоты (ДНК и РНК).
Генетические маркеры — нуклеотидные последовательности с известной первичной структурой, которые позволяют проводить идентификацию анализируемой НК.
Полимеразная цепная реакция (ПЦР) — метод обнаружения специфического участка НК в исследуемом биологическом материале путем амплификации in vitro.
Амплификация — процесс многократного копирования специфического участка ДНК (кДНК), ограниченного (фланкированного) праймерами.
Ампликоны — продукты ПЦР, синтезируемые в процессе амплификации копии ДНК-мишени.
Лабораторная контаминация НК — механический занос положительно реагирующих НК, прежде всего ампликонов, в исследуемые образцы, приводящий к ложноположительным результатам.
Приложение N 2
(рекомендуемое)
ПЕРЕЧЕНЬ ОБОРУДОВАНИЯ ПЦР-ЛАБОРАТОРИИ
Для обработки материала и выделения НК
1. Центрифуга для пробирок объемом 5-100 мл.
2. Центрифуга-вортекс.
3. Микроцентрифуга от 12 до 16000 g для микроцентрифужных пробирок объемом 1,5 мл.
4. Твердотельный термостат для пробирок объемом 1,5 мл с диапазоном рабочих температур 25-100 град. С.
5. Отдельный набор автоматических пипеток переменного объема.
6. Одноразовые полипропиленовые микроцентрифужные пробирки с завинчивающимися или плотно закрывающимися крышками объемом 1,5 мл.
7. Одноразовые наконечники для пипеток переменного объема с аэрозольным барьером до 200 и до 1000 мкл.
8. Одноразовые наконечники для пипеток переменного объема до 200 мкл.
9. Штативы для наконечников, микропробирок объемом 1,5 мл.
10. Холодильник с камерами, поддерживающими температуру от 2 до 8 град. С, минус 20 град. С.
11. Емкость с дезинфицирующим раствором.
Для приготовления ПЦР-смеси и проведения амплификации
1. Настольный бокс с бактерицидной лампой.
2. Амплификатор.
3. Отдельный набор автоматических пипеток переменного объема.
4. Одноразовые полипропиленовые пробирки для амплификации объемом 0,5 (0,2) мл.
5. Одноразовые наконечники для пипеток переменного объема с аэрозольным барьером до 100 мкл.
6. Штативы для наконечников, микропробирок на 0,5 (0,2) мл.
7. Холодильник с камерами, поддерживающими температуру от 2 до 8 град. С, минус 20 град. С.
8. Емкость для сброса отработанных расходных материалов.
Для электрофоретического анализа продуктов ПЦР
1. Камера для горизонтального электрофореза.
2. Источник постоянного тока с напряжением 150-460 В.
3. Трансиллюминатор с кабинетом для просмотра гелей.
4. Видеосистема с цифровой видеокамерой для регистрации результатов.
5. Компьютер для анализа результатов электрофореза.
6. Микроволновая печь для плавления агарозы.
7. Колба коническая из термостойкого стекла для плавления агарозы объемом 250 мл.
8. Мерный цилиндр объемом 1 л.
9. Штатив для микропробирок на 0,5 мл.
10. Отдельная автоматическая пипетка 10-40 мкл.
11. Одноразовые наконечники для пипеток переменного объема до 200 мкл в штативе.
12. Холодильник с камерой, поддерживающей температуру от 2 до 8 град. С.
13. Емкость для сброса отработанных расходных материалов.
Для гибридизационно-ферментной детекции продуктов ПЦР
1. Термостат планшетный, поддерживающий температуру 37 град. С.
2. Вошер (не обязательно).
3. Планшетный спектрофотометр.
4. Компьютер (должен быть связан через компьютерную сеть с компьютером, располагающимся в чистой зоне и предназначенным для анализа результатов гибридизации).
5. Восьмиканальная пипетка до 200 мкл.
6. Отдельный набор одноканальных автоматических пипеток переменного объема.
7. Одноразовые наконечники для пипеток переменного объема.
8. Мерный цилиндр объемом 1 л.
9. Холодильник с камерой, поддерживающей температуру от 2 до 8 град. С.
10. Емкость для сброса отработанных расходных материалов.
Приложение N 3
(рекомендуемое)
ДЕЙСТВИЯ ПРИ КОНТАМИНАЦИИ ЛАБОРАТОРИИ НУКЛЕИНОВЫМИ КИСЛОТАМИ
1. Сотрудников, проводящих мероприятия по деконтаминации, обеспечивают одноразовыми халатами, шапочками, бахилами и перчатками, одноразовой ветошью, емкостями для приготовления необходимых количеств моющих и дезинфицирующих растворов.
2. Каждую зону лаборатории обрабатывают работающие в ней сотрудники.
3. Для обработки каждой зоны используют новый набор уборочного инвентаря.
4. Каждую зону лаборатории разбивают на участки уборки, например:
— участок 1 — бокс биологической безопасности и оборудование внутри него;
— участок 2 — внешние поверхности бокса биологической безопасности;
— участок 3 — шкафы для расходного материала;
— участок 4 — холодильники для хранения реактивов, образцов проб;
— участок 5 — оборудование, которое используют в работе, но стоит вне бокса биологической безопасности;
— участок 6 — поверхности помещения (стены, окна, батареи, потолок, двери и т.д.);
— участок 7 — пол.
5. Обработку проводят от участка к участку последовательно. Каждый участок обрабатывают отдельной ветошью. Перед обработкой персонал надевает одноразовую одежду, бахилы, шапочки, перчатки; готовит моющие и дезинфицирующие растворы.
6. Поверхности каждого участка вначале обрабатывают моющим раствором для удаления жировых загрязнений, после чего остатки моющего средства удаляют ветошью, смоченной водой.
7. Затем на поверхность наносят на 30 минут дезинфицирующий раствор (например, 0,2%-ный раствор ДП-2Т или аналогичные ему, разрешенные к применению для этих целей в установленном порядке). Остатки дезинфицирующего средства тщательно удаляют ветошью, смоченной водой.
8. После завершения указанной обработки проводят обеззараживание ультрафиолетовым излучением влажных поверхностей в течение 1 ч.
9. Мероприятия, описанные в п.п. 7 и 8, повторяют еще раз.
10. Каждый последующий этап обработки проводят в новой одноразовой одежде (халат, шапочка, бахилы, перчатки) с использованием новой ветоши. Для удаления остатков нанесенных на поверхность дезинфицирующих средств ветошь тщательно прополаскивают в чистой воде, обрабатываемую поверхность протирают несколько раз. После каждого этапа обработки ветошь утилизируют.
11. По завершении деконтаминации берут повторные смывы, которые исследуют на наличие НК возбудителей инфекционных заболеваний, диагностику которых наиболее часто осуществляют в данной лаборатории, а также на выявление НК возбудителей, имеющих короткие — менее 300 п.н. — специфические продукты амплификации (длина специфического фрагмента указана в инструкциях к тест-системе).
12. Для проведения смывов стерильный зонд с ватным тампоном смачивают в физиологическом растворе или ТЕ-буфере (10 mM Tris, 1 mМ ЭДТА), после чего вращательными движениями протирают рабочие поверхности оборудования, мебели, дверных ручек и косяков, телефонов и т.п. Особое внимание уделяют помещениям совместного посещения работников зоны детекции продуктов амплификации и других сотрудников лаборатории (столовая, санузел и т.п.). После взятия смыва зонд помещают в микропробирки типа «эппендорф» с 300-400 мкл ТЕ-буфера, вращают в течение 10-15 с, избегая разбрызгивания раствора, и, отжав избыток жидкости о стенки пробирки, удаляют.
13. В случае получения в образцах смывов положительных результатов ПЦР-анализа обработку повторяют.
14. Загрязненный расходный материал (пробирки, наконечники и т.п.) утилизируют.
Диагностические лаборатории медицинских организаций, как правило, осуществляют работы с патогенными биологическими агентами (ПБА) III–IV групп патогенности. Чтобы обеспечить в лаборатории требования биологической безопасности, необходимо предусмотреть поточность технологических процессов, зонирование производственных помещений, своевременное проведение дезинфекционных мероприятий. Расскажем о том, как это сделать.
ПБА — это патогенные для человека микроорганизмами и гельминты, а также любые объекты и биологические материалы, подозрительные на их содержание. Классификация микроорганизмов по группам патогенности представлена в СП 1.3.2322-08 «Безопасность работы с микроорганизмами III–IV групп патогенности (опасности) и возбудителями паразитарных болезней».
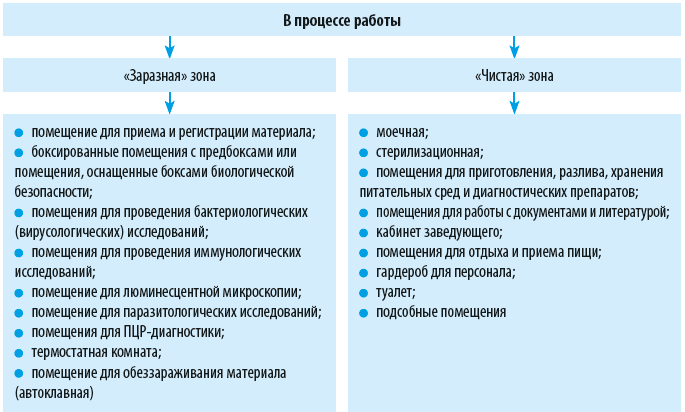
Зонирование лаборатории
Лаборатория должна иметь 2 входа: один — для персонала, второй — для приема биологического материала на исследования. На входных дверях должно быть обозначено название лаборатории и размещен международный знак «Биологическая опасность».
Производственные помещения лаборатории разделяют на «заразную» и «чистую» зоны (см. схему). В «заразной» зоне выполняют любые виды работ с микроорганизмами и биологическим материалом. «Чистая» зона предназначена для тех видов деятельности, при которых невозможен контакт с патогенными биологическими агентами.
На границе «чистой» и «заразной» зон лаборатории целесообразно предусмотреть санитарный пропускник.
Рабочие столы, стеллажи, оборудование в «заразной» зоне маркируют с помощью международного знака «Биологическая опасность». Помещения «заразной» зоны оборудуют бактерицидными облучателями.
Обратите внимание!
Выносить за пределы лаборатории оборудование, лабораторную или хозяйственную посуду, реактивы, инструменты и прочие объекты можно только после их дезинфекции и с разрешения руководителя лаборатории.
Требования к отделке помещений лаборатории
Поверхности пола, стен, потолка, мебели, оборудования и прочих объектов в помещениях лаборатории должны быть гладкими, устойчивыми к влажной уборке с применением моющих и дезинфицирующих средств. Для пола необходимо предусмотреть гидроизоляцию и антискользящее покрытие.
Батареи отопления в «заразной» зоне располагают на достаточном расстоянии от стен, чтобы обеспечить возможность их дезинфекции.
Окна и двери помещений «заразной» зоны лаборатории должны быть герметичными, иметь запирающие устройства.
Если лаборатория располагается на первом этаже или в цоколе, то окна обязательно оснащают металлическими решетками, не нарушающими правил пожарной безопасности. Для защиты рабочих столов от попадания прямого солнечного света используют светозащитную пленку или жалюзи из материалов, устойчивых к воздействию дезсредств.
Доставка и прием биологического материала
Биологический материал для исследований в лабораторию должен доставляться в закрытых контейнерах, биксах или в сумках-холодильниках, промаркированных с помощью международного знака «Биологическая опасность».
На дно контейнера для транспортировки укладывают адсорбирующий материал (марлевую салфетку, ткань, вату).
Обратите внимание!
Не допускается доставка материала в хозяйственных сумках, чемоданах, портфелях и других предметах личного пользования.
Чтобы исключить контакт бланков-направлений с биологическим материалом, их вкладывают в отдельный полиэтиленовый пакет.
Важно!
Персонал лаборатории должен осуществлять прием и разбор биологического материала с использованием средств индивидуальной защиты: масок и резиновых перчаток.
Работа с патогенными биологическими агентами
Во время работы в «заразной» зоне лаборатории следует соблюдать максимальную осторожность и применять средства индивидуальной защиты. При пипетировании необходимо пользоваться резиновыми грушами или автоматическими устройствами.
Важно!
Запрещается пипетировать ртом и переливать жидкий инфекционный материал через край пробирки, покидать рабочее место во время манипуляций с ПБА, удалять необеззараженные сгустки крови из пробирок вытряхиванием, сливать жидкие отходы в канализацию без предварительного обеззараживания.
Работы с ПБА, представляющие наибольшую опасность для медицинского персонала и окружающей среды, должны выполняться в боксированных помещениях «заразной» зоны лаборатории или в боксах биологической безопасности II класса. К таким работам относятся:
- центрифугирование ПБА и другие манипуляции, вследствие которых образуются аэрозоли;
- приготовление суспензий;
- работа с лиофилизированными ПБА;
- работа по ведению коллекционных штаммов;
- работа по идентификации и изучению выделенных штаммов микроорганизмов.
- серологические исследования и ПЦР-исследованияпо детекции в клиническом материале возбудителей парентеральных вирусных гепатитов В и С, ВИЧ-инфекции и других микроорганизмов II группы патогенности.
Во время работ двери боксов и предбоксов должны быть закрыты. До момента окончания работ выход из боксов не допускается.
Перед началом работ с использованием боксов биологической безопасности включают вентиляцию, проверяют исправность оборудования, наличие аварийного запаса дезинфицирующих средств. Манипуляции с ПБА должны выполняться ближе к задней стенке бокса на поддонах с салфетками, смоченными дезинфицирующим раствором.
После окончания работ с ПБА переднюю панель бокса биологической безопасности опускают, внутри бокса включают бактерицидные лампы.
Обратите внимание!
Боксы биологической безопасности должны проверяться на защитную эффективность:
-
после монтажа и подготовки к использованию;
-
после перемещения или ремонта;
-
не реже одного раза в год при наличии фильтров предварительной очистки воздуха от крупнодисперсных частиц;
-
не реже 2 раз в год при отсутствии фильтров предварительной очистки воздуха от крупнодисперсных частиц.
При проверке боксов должны контролироваться параметры эффективности работы фильтров очистки воздуха и скорость воздушного потока в рабочем проеме бокса.
По окончании работ в «заразной» зоне все объекты, содержащие ПБА, должны быть убраны в холодильники, термостаты или лабораторные шкафы. При наличии коллекции культур микроорганизмов их хранилища опечатываются. Все рабочие поверхности дезинфицируются. Помещения «заразной» зоны лаборатории запираются и опечатываются.
Дезинфекционные мероприятия в лаборатории
При организации дезинфекционных мероприятий в лабораториях применяют физические и химические методы дезинфекции.
Для обеззараживания лабораторной посуды, защитной одежды персонала, бактериологических посевов, а также жидких отходов можно применять паровые стерилизаторы.
В воздушных стерилизаторах допускается обеззараживать лабораторную посуду из стекла, металлов или силикона, не загрязненную органическими веществами.
Обратите внимание!
Параметры паровой и воздушной стерилизации контролируют с помощью максимальных термометров, которые размещаются в контрольных точках. Количество контрольных точек зависит от объема камеры стерилизатора. Параметры паровой стерилизации дополнительно контролируются при помощи мановакуумметров.
Химический контроль термической стерилизации осуществляют при каждом цикле работы с использованием специальных тест-индикаторов, необходимое количество и точки расположения которых зависят от вида аппаратуры и объема стерилизационной камеры.
Контроль стерилизации с помощью бактериологических методов (биотестов) должен осуществляться не реже 2 раз в год, а также после ввода в эксплуатацию и ремонта аппаратуры. Биотесты, содержащие некоторое количество жизнеспособных микроорганизмов, обладающих высокой резистентностью, помещают в контрольные точки стерилизационной камеры. При качественно проведенном процессе стерилизации микроорганизмы погибают. Вид применяемых биотестов зависит от типа стерилизационного оборудования.
Химическими методами проводят обеззараживание различных поверхностей, медицинской мебели, оборудования, жидких отходов, спецодежды и других объектов.
К сведению
При выборе химических дезинфектантов предпочтение следует отдавать средствам с широким спектром антимикробной активности.
Объекты, загрязненные кровью, необходимо дезинфицировать растворами, обладающими активностью в отношении возбудителей парентеральных инфекций.
Рабочие растворы дезсредств готовят в специально отведенных помещениях или в вытяжном шкафу. Контейнеры (емкости) с растворами маркируют, указывая название дезсредства и его назначение, концентрацию раствора, дату приготовления и дату конечной реализации.
Дезсредства, применяемые для проведения текущих и генеральных уборок, должны обладать моющими свойствами. Текущую уборку проводят 2 раза в день. Обрабатывают полы, мебель, оборудование, подоконники, двери.
Генеральные уборки проводят не реже 1 раза в месяц, в боксированных помещениях — не реже 1 раза в неделю.
Во время генеральных уборок моют и дезинфицируют стены на высоту до 2 м, пол, плинтусы, двери, окна, мебель, аппараты, приборы. Для «чистой» и «грязной» зон используют отдельный уборочный инвентарь, который должен быть промаркирован и использоваться строго по назначению.
После влажной уборки включают бактерицидные облучатели. Их следует эксплуатировать в соответствии с действующими методическими документами и инструкциями по применению конкретного оборудования.
Обратите внимание!
Если в течение дня нужно экстренно обработать небольшие по площади или труднодоступные поверхности, следует использовать готовые к применению формы дезсредств, которые имеют небольшое время экспозиции и выпускаются в виде спреев или дезинфицирующих салфеток.
Медицинские изделия и посуду дезинфицируют способом полного погружения в рабочий раствор дезинфицирующего средства. Разъемные изделия обеззараживают в разобранном виде, каналы и полости изделий заполняют дезинфицирующим раствором.
Особенности обращения с отходами лабораторий
Все отходы, образующиеся в «заразной» зоне лаборатории, считаются эпидемиологически опасными, т. е. относятся к классу Б, и должны подвергаться обеззараживанию.
Твердые отходы, которые образуются в «заразной» зоне лаборатории, собирают в одноразовые пакеты или контейнеры желтого цвета или имеющие желтую маркировку, подвергают дезинфекции химическими или физическими методами.
Жидкие отходы из «заразной» зоны запрещено сливать в канализационную сеть без предварительного обеззараживания. Чаще всего их смешивают с растворами дезсредств в пропорциях, указанных в инструкциях по применению конкретных дезинфектантов.
Лабораторную посуду с культурами микроорганизмов, как правило, обеззараживают в паровых стерилизаторах.
Важно!
Пробирки со сгустками крови обеззараживают с использованием дезинфицирующих растворов или с применением физических методов дезинфекции. Вытряхивать необеззараженные сгустки крови из пробирок запрещено.
При погружении в дезинфицирующий раствор пробирок со сгустками крови необходимо соблюдать осторожность. Пробирку берут анатомическим пинцетом так, чтобы одна его бранша вошла немного внутрь, и погружают ее в наклонном положении до полного заполнения раствором. При правильном погружении воздушные пузыри не образуются, пробирка опускается на дно.
Техника безопасности и ликвидация аварийных ситуаций

Помещения лаборатории должны быть оборудованы пожарной сигнализацией и обеспечены средствами пожаротушения в соответствии с требованиями пожарной безопасности.
Сотрудники диагностических лабораторий должны быть обеспечены спецодеждой соответствующего размера: медицинскими халатами и костюмами, шапочками, медицинской обувью и средствами индивидуальной защиты, в том числе перчатками и масками, респираторами.
Для работы в боксированных помещениях используют отдельный халат, доходящий до нижней трети голени, и тапочки.
Рабочая одежда и обувь должны быть индивидуальными, храниться отдельно от личной одежды. Смена рабочей одежды проводится по мере загрязнения, но не реже 1 раза в неделю. Стирать спецодежду следует централизованно. Перед сдачей в стирку защитную одежду обеззараживают.
В лабораториях не допускается применение материалов и средств личной гигиены, раздражающих кожу. После окончания работ с ПБА, при переходе из «заразной» зоны в чистую, а также после уборочных работ и проведения дезинфекции персонал лаборатории должен выполнять гигиеническую обработку рук, используя кожные антисептики.
Важно!
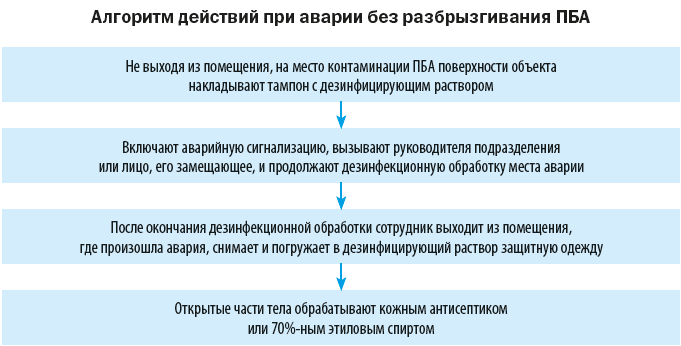
На случай аварийных ситуаций, при которых создается угроза выделения ПБА в воздух рабочей зоны или есть риск заражения персонала, в лаборатории должен быть план ликвидации аварии и запас дезинфицирующих средств.
Объем мероприятий по ликвидации аварии зависит от характера выполняемой работы, вида и свойств ПБА, масштабов аварии.

Кроме того, в специально отведенном месте хранят аварийную аптечку, гидропульт, комплекты рабочей одежды для переодевания пострадавших и защитной одежды для сотрудников, ликвидирующих последствия аварии. Ответственным за комплектование аптечки и аварийной укладки является заведующий лабораторией.
Состав аварийной аптечки:
1. Спирт этиловый 70%-ный — 2 флакона по 100 мл.
2. Спиртовой раствор йода 5%-ный — 1 флакон.
3. Раствор борной кислоты 1%-ный — 1 флакон.
4. Нашатырный спирт — 1 флакон.
5. Бинт марлевый медицинский стерильный (5 м × 10 см) — 2 шт.
6. Лейкопластырь бактерицидный (не менее 1,9 см × 7,2 см) — 3 шт.
7. Салфетка марлевая медицинская стерильная (не менее 16 см × 14 см, № 10) — 1 уп.
8. Ножницы с закругленными браншами.
При аварии во время работы на центрифуге крышку медленно открывают только спустя 30–40 минут, чтобы сформировавшийся аэрозоль успел осесть. Центрифужные стаканы и разбитое стекло помещают в дезинфицирующий раствор, поверхность крышки, внутренние части центрифуги, ее наружную поверхность дезинфицируют (после отключения ее от электросети).

О каждом случае аварийной ситуации руководитель лаборатории обязан сообщить комиссии по контролю соблюдения требований биологической безопасности, а также руководителю медорганизации.
Не реже 1 раза в год в лаборатории должны проводиться тренировочные учения по ликвидации аварий.
Допуск персонала к работе с ПБА
Допуск персонала к работе с ПБА III–IV групп патогенности, а также допуск инженерно-технического персонала к обслуживанию лабораторного оборудования должен осуществляться на основании приказа главного врача. Приказ издается не реже одного раза в два года, корректируется по мере необходимости.
В лабораториях медорганизаций работу с ПБА могут выполнять специалисты не моложе 18 лет с высшим и средним медицинским или биологическим образованием, прошедшие необходимую профессиональную подготовку.
Лица, имеющие медицинские противопоказания к вакцинации, лечению специфическими препаратами, использованию средств индивидуальной защиты, к работам с ПБА не допускаются.
Не реже 1 раза в год медицинский персонал, работающий с ПБА, должен проходить инструктаж по соблюдению требований биологической безопасности. Инженерно-технический персонал, дезинфекторы и санитарки лаборатории также должны проходить вводные и периодические инструктажи по биологической безопасности.
При приеме на работу сотрудников лаборатории направляют на предварительный медицинский осмотр для выявления противопоказаний с учетом специфики трудовой деятельности[1].
Все сотрудники, которые привлекаются к работам с ПБА, должны быть привиты в соответствии с календарем профилактических прививок и календарем прививок по эпидемическим показаниям.
К работе с паровыми стерилизаторами (автоклавами) могут быть допущены лица, обученные, аттестованные и имеющие удостоверение на право обслуживания сосудов, работающих под давлением.
Организация работы комиссии по биологической безопасности
Для контроля за соблюдением мер биологической безопасности при работе с ПБА в медорганизации создается специальная комиссия. В ее состав, как правило, включают заведующего лабораторией, врача-эпидемиолога или его помощника, инженера по охране труда и других заинтересованных специалистов.
Задачи комиссии по биологической безопасности:
- организация и проведение постоянного контроля за соблюдением регламентированного порядка обеспечения биологической безопасности лаборатории;
- разработка комплекса мер по совершенствованию биологической безопасности;
- организация и проведение мероприятий, направленных на предупреждение аварийных ситуаций при работе с ПБА и ликвидацию их последствий;
- контроль за подготовленностью сотрудников к работе с ПБА и организация наблюдения за состоянием их здоровья.
Заседания комиссии проводятся не реже 2 раз в год. Решения комиссии доводятся до сведения руководителя медорганизации.
[1] Объем и порядок проведения медосмотра определяются Приказом Минздравсоцразвития России от 12.04.2011 № 302н (в ред. от 06.02.2018) «Об утверждении перечней вредных и (или) опасных производственных факторов и работ, при выполнении которых проводятся обязательные предварительные и периодические медицинские осмотры (обследования), и порядка проведения обязательных предварительных и периодических медицинских осмотров (обследований) работников, занятых на тяжелых работах и на работах с вредными и (или) опасными условиями труда».
Статья опубликована в журнале «Санэпидконтроль. Охрана труда» № 1, 2019.
Опубликовано: 23.04.2025 04:57:55
Cодержание статьи:

Санитарно-эпидемиологические правила СП 1.3.2322-08 «Безопасность работы с микроорганизмами III-IV групп патогенности (опасности) и возбудителями паразитарных болезней»
I. Область применения
1.1. Настоящие санитарно-эпидемиологические правила (далее — санитарные правила) разработаны в соответствии с Федеральным законом от 30.03.1999 N 52-ФЗ «О санитарно-эпидемиологическом благополучии населения».
1.2. Санитарные правила устанавливают требования к организационным, санитарно-противоэпидемическим (профилактическим) мероприятиям, направленным на обеспечение личной и общественной безопасности, защиту окружающей среды при работе с патогенными биологическими агентами III-IV групп (далее — ПБА III-IV групп или ПБА) — патогенными для человека микроорганизмами и гельминтами, а также любыми объектами и материалами, включая полевой, клинический, секционный, подозрительными на содержание указанных ПБА.
1.3. Санитарные правила предназначены для юридических лиц независимо от организационно-правовых форм и форм собственности и индивидуальных предпринимателей, проводящих на территории Российской Федерации работы с объектами и материалами, содержащими или подозрительными на содержание ПБА III-IV групп.
1.4. Соблюдение требований санитарных правил является обязательным для юридических лиц независимо от организационно-правовых форм и форм собственности и индивидуальных предпринимателей, проводящих работу с ПБА:
III группы:
— диагностические с целью обнаружения и выделения возбудителя, экспериментальные и производственные работы;
— ПЦР-диагностику;
— диагностические исследования на холеру и ботулинический токсин, выполняемые с целью профилактики этих инфекций;
— иммунологические исследования с ПБА III группы;
— иммунологические исследования по обнаружению в крови людей антигенов микроорганизмов II группы патогенности (без накопления возбудителя) и/или антител к ним;
— экспериментальные и производственные работы с вакцинными штаммами возбудителей I-II групп патогенности, официально отнесенными к III группе;
— исследования по контролю объектов окружающей среды и качества продукции.
IV группы:
— диагностические с целью обнаружения и выделения возбудителя, экспериментальные и производственные работы;
— иммунологические исследования с ПБА III группы (без накопления возбудителя);
— исследования по контролю объектов окружающей среды и качества продукции на наличие санитарно-показательных микроорганизмов;
— ПЦР-исследования.
II. Требования к организации работ с патогенными биологическими агентами III-IV групп
2.1. Общие требования
2.1.1. Деятельность юридических лиц, независимо от организационно-правовых форм и форм собственности, и индивидуальных предпринимателей, связанная с использованием ПБА III-IV групп и возбудителями паразитарных болезней должна осуществляться в соответствии с Федеральным законом «О лицензировании отдельных видов деятельности» от 8 августа 2001 г. N 128-ФЗ.
2.1.2. Деятельность каждого структурного подразделения (микробиологической лаборатории, цеха, производственного участка и т.п. ), связанная с использованием ПБА III-IV групп, должна осуществляться на основании санитарно-эпидемиологического заключения в соответствии с Федеральным законом «О санитарно-эпидемиологическом благополучии населения».
2.1.3. Учет, хранение, передача и транспортирование ПБА III-IV групп должны осуществляться в соответствии с действующими санитарно-эпидемиологическими правилами. Передача ПБА III-IV групп в организации, не имеющие лицензии на деятельность, связанную с использованием возбудителей инфекционных заболеваний соответствующих групп патогенности, не допускается. Хранение ПБА III — IV групп должно осуществляться в помещении «заразной» зоны. В отдельных случаях по согласованию с органами, осуществляющими государственный санитарно-эпидемиологический надзор, допускается их хранение в специально выделенном и оборудованном помещении «чистой» зоны, упакованными в соответствии с требованиями, предъявляемыми к транспортированию ПБА III — IV групп.
2.1.4. Работа с рекомбинантными молекулами ДНК ПБА III-IV групп регламентируется Федеральным законом от 5 июля 1996 г. N 86-ФЗ «О государственном регулировании в области генно-инженерной деятельности» (Собрание законодательства Российской Федерации, 1996, N 28, ст. 3348; Российская газета, N 135, 14.07.2000), нормативными документами по безопасности работы с рекомбинантными молекулами ДНК, действующими санитарно-эпидемиологическими правилами.
2.1.5. Работа по производству медицинских иммунобиологических препаратов с использованием ПБА III-IV групп регламентируется настоящими санитарными правилами и другими нормативными документами, содержащими требования к помещениям, оборудованию, технике безопасности и производственной санитарии.
2.1.6. Исследования на холеру и ботулинический токсин, выполняемые с целью профилактики холеры и ботулизма, иммунологические (серологические) исследования по обнаружению в крови людей антигенов микроорганизмов II группы патогенности (без накопления возбудителя) и/или антител к ним, ПЦР-исследования (без накопления возбудителя) по детекции в клиническом материале возбудителей бруцеллеза, парентеральных вирусных гепатитов В и С, СПИД и других микроорганизмов II группы патогенности, регламентированные действующими нормативно-методическими документами, могут проводиться в лабораториях, работающих с микроорганизмами III группы патогенности. Иммунологические (серологические) исследования и ПЦР-исследования проводят в боксированном помещении или в боксе биологической безопасности.
2.1.7. Для каждого структурного подразделения, проводящего работы с ПБА III-IV групп, должен быть разработан документ, определяющий режим безопасной работы в конкретных условиях, с учетом характера работ, особенностей технологии, свойств микроорганизма и продуктов его жизнедеятельности. При этом требования безопасности не должны быть ниже требований, регламентируемых настоящими санитарными правилами. Документ должен быть согласован с комиссией по контролю соблюдения требований биологической безопасности организации и утвержден руководителем. При разработке и/или внедрении новых методов и методических приемов, требующих усиления мер безопасности, в документ вносят соответствующие дополнения.
2.2. Требования к оформлению допуска персонала к работам с патогенными биологическими агентами III-IV групп и к медицинскому наблюдению за персоналом
2.2.1. Работу с ПБА III-IV групп могут выполнять специалисты не моложе 18 лет с высшим и средним медицинским, биологическим, ветеринарным и иным образованием в соответствии с принятым каждым ведомством порядком замещения должностей, окончившие соответствующие курсы специализации с освоением методов безопасной работы с ПБА III-IV групп, не имеющие медицинских противопоказаний к вакцинации, лечению специфическими препаратами и к работе в средствах индивидуальной защиты.
2.2.2. Допуск персонала к работе с ПБА III-IV групп должен осуществляться на основании приказа руководителя организации, издаваемого один раз в два года с учетом требований п. 2.2.1 настоящего раздела, и проверки знаний персоналом требований биологической безопасности. Инструктажи по соблюдению требований биологической безопасности должны проводиться не реже 1 раза в год.
2.2.3. Инженерно-технический персонал, дезинфекторы и санитарки структурного подразделения, осуществляющего деятельность с использованием ПБА III-IV групп, должны проходить вводные и периодические инструктажи по биологической безопасности по месту работы в соответствии с должностными обязанностями. Допуск инженерно-технического персонала к обслуживанию оборудования оформляется на основании приказа руководителя организации один раз в два года.
2.2.4. Разрешение на посещение лаборатории, цеха, участка, конкретного рабочего места инженерно-техническому персоналу, не работающему постоянно в организации, выдает руководитель подразделения. Посещение должно осуществляться в сопровождении сотрудника структурного подразделения после прекращения работы и проведения текущей дезинфекции. Посещение должно регистрироваться в специальном журнале.
2.2.5. Специалисты, постоянно не работающие в организации, могут быть допущены к работе с ПБА III-IV групп на общих основаниях в соответствии с требованиями пункта 2.2.1 настоящего раздела.
2.2.6. При приеме на работу, связанную с использованием ПБА III-IV групп, персонал должен проходить предварительный медицинский осмотр с целью выявления медицинских противопоказаний к вакцино-профилактике, лечению специфическими препаратами и применению средств индивидуальной защиты. Объем и порядок проведения медосмотра определяются действующими нормативными документами. Все сотрудники, привлекаемые к работам с ПБА III-IV групп, должны проходить периодические медицинские осмотры в соответствии с нормативными документами.
2.2.7. У сотрудников лабораторий, проводящих серологические исследования на ВИЧ-инфекцию и гепатиты В и С, ежегодно проводятся контрольные исследования на наличие соответствующих антигенов (антител) в сыворотке крови.
2.2.8. Сотрудники, работающие с кровью (сывороткой, плазмой крови), должны быть иммунизированы против вирусных гепатитов, а выполняющие исследования на энтеровирусы, — против полиомиелита.
2.2.9. В случае появления у сотрудника симптомов, характерных для инфекционного заболевания, вызываемого возбудителем, с которым он работал, сотрудник должен ставить об этом в известность руководителя подразделения.
2.3. Требования к помещениям и оборудованию лаборатории
2.3.1. Микробиологические лаборатории, где проводят работы с ПБА III-IV групп, должны размещаться в отдельно стоящем здании или в изолированной части здания. На входной двери лаборатории должны быть обозначены название (номер) лаборатории и международный знак «Биологическая опасность». Размещение лабораторий в жилых зданиях не допускается.
2.3.2. Производственные лаборатории, проводящие работу с ПБА III группы, должны располагаться в отдельно стоящих зданиях или изолированном блоке здания, имеющем отдельный вход, а производственные лаборатории, работающие с ПБА IV группы, могут располагаться в изолированном блоке производственного корпуса.
2.3.3. Диагностические лаборатории, проводящие исследования с ПБА III-IV групп, должны иметь 2 входа: один — для сотрудников, другой — для доставки материала на исследование. Допускается получение материала через передаточное окно. В лабораториях научно-исследовательских организаций, проводящих экспериментальные исследования с ПБА III-IV групп, а также в производственных лабораториях допускается наличие одного входа.
2.3.4. Лаборатория должна быть обеспечена холодным и горячим водоснабжением, канализацией, электричеством, отоплением и вентиляцией. Все помещения лаборатории должны иметь естественное и искусственное освещение в соответствии с требованиями действующих нормативных документов.
2.3.5. Объемно-планировочные решения и размещение оборудования должны обеспечивать поточность движения ПБА III-IV групп, персонала и выполнение требований настоящих санитарных правил.
2.3.6. Лаборатории должны иметь набор рабочих и вспомогательных помещений (комнат). Набор помещений и их оснащение оборудованием могут варьироваться в зависимости от конкретных целей и задач лаборатории.
2.3.7. Помещения лабораторий разделяют на «заразную» зону, где осуществляются манипуляции с ПБА III-IV групп и их хранение, и «чистую» зону, где не проводят работы с микроорганизмами и их хранение.
В «чистой» зоне лабораторий должны располагаться следующие помещения:
— гардероб для верхней одежды;
— помещения для проведения подготовительных работ (препараторская, моечная, приготовление и разлив питательных сред и др.);
— помещение для стерилизации питательных сред и лабораторной посуды (стерилизационная);
— помещение с холодильной камерой или холодильниками для хранения питательных сред и диагностических препаратов;
— помещение для работы с документами и литературой;
— помещение для отдыха и приема пищи;
— кабинет заведующего;
— помещение для хранения и одевания рабочей одежды;
— подсобные помещения;
— туалет.
Для работы с ПБА III-IV групп в «заразной» зоне должны размещаться:
— помещение для приема и регистрации материала (проб);
— боксированные помещения с предбоксами или помещения, оснащенные боксами биологической безопасности;
— помещения для проведения бактериологических (вирусологических) исследований;
— помещения для проведения иммунологических исследований;
— помещение для люминесцентной микроскопии;
— помещение для проведения зооэнтомологических работ;
— помещение для паразитологических исследований;
— помещение для работы с лабораторными животными (заражение, вскрытие);
— помещение для содержания инфицированных лабораторных животных;
— помещения для ПЦР-диагностики;
— термостатная комната;
— помещение для обеззараживания (автоклавная).
2.3.8. На границе «чистой» и «заразной» зон, во вновь строящихся или реконструируемых лабораториях, должно предусматриваться устройство санитарных пропускников.
2.3.9. В лабораториях, проводящих исследования с ПБА только IV группы, в «заразной» зоне должны располагаться:
— комната для посевов;
— комната для проведения исследований с ПБА;
— комната для обеззараживания и стерилизации.
— душевая в санитарном пропускнике на границе «чистой» и «заразной» зон;
Обязательна маркировка автоклавов, столов, стеллажей и разделение движения инфекционного и чистого материалов во времени.
2.3.10. При расположении в одном блоке нескольких микробиологических лабораторий общими для них могут быть: блок для работы с инфицированными животными, автоклавные для обеззараживания, моечные, комнаты для приготовления питательных сред и другие вспомогательные помещения.
2.3.11. Внутренняя отделка помещений должна быть выполнена в соответствии с их функциональным назначением и гигиеническими нормативами. Поверхность пола, стен, потолка в лабораторных помещениях «заразной» зоны должна быть гладкой, без щелей, устойчивой к многократному действию моющих и дезинфицирующих средств. Полы должны быть не скользкими, иметь гидроизоляцию. В помещении «заразной» зоны не допускается устройство подвесных потолков, не отвечающих указанным требованиям, и подпольных каналов.
2.3.12. В помещениях «заразной» зоны выступающие и проходящие трубы (батареи отопления) располагают на расстоянии от стен с целью возможности проведения их дезинфекции, места ввода инженерных коммуникаций должны быть герметичными. Отопительные приборы должны иметь гладкую легко очищаемую поверхность.
2.3.13. Окна и двери помещений «заразной» зоны лаборатории должны быть герметичными. Допускается заполнение оконных проемов стеклоблоками. Окна цокольного и первого этажей независимо от наличия охранной сигнализации должны быть оснащены металлическими решетками, не нарушающими правил пожарной безопасности. Двери должны иметь запирающие устройства.
2.3.14. Входные двери в помещениях для работы с инфицированными животными должны оборудоваться высокими порогами, недоступными для проникновения грызунов.
2.3.15. Приборы, оборудование и средства измерений, используемые в работе лаборатории, должны быть аттестованы, технически исправны, иметь технический паспорт и рабочую инструкцию по эксплуатации с учетом требований биологической безопасности. Средства измерения подвергают метрологическому контролю в установленные сроки.
2.3.16. Планово-предупредительный ремонт лабораторного оборудования и инженерных систем обеспечения биологической безопасности подразделений осуществляют инженерно-технические службы и специалисты в соответствии с годовым графиком.
2.3.17. Лабораторное оборудование и мебель (столы, стеллажи для содержания животных, стулья и т.д. ) должны быть гладкими, без острых краев и шероховатостей и иметь покрытие, устойчивое к действию моющих и дезинфицирующих средств. Поверхность столов не должна иметь швов и трещин. В помещениях «заразной» зоны не допускается использование мебели из древесины и с мягким покрытием.
2.3.18. Ширина проходов к рабочим местам или между двумя рядами выступающего оборудования должна быть не менее 1,5 метра.
2.3.19. Помещения «заразной» зоны должны быть оборудованы бактерицидными облучателями для обеззараживания воздуха и поверхностей в соответствии с нормативами.
2.3.20. В лабораторных помещениях должна быть предусмотрена защита рабочих столов от попадания прямого солнечного света. Для этих целей могут быть использованы светозащитная пленка, жалюзи из материала, устойчивого к воздействию дезинфицирующих растворов.
2.3.21. Помещения лабораторий должны быть непроницаемы для грызунов и насекомых.
2.3.22. Лабораторные помещения должны быть оборудованы пожарной сигнализацией и обеспечены средствами пожаротушения в соответствии с требованиями пожарной безопасности.
2.3.23. Все жидкие отходы, образующиеся в процессе работы в «заразной» зоне, перед сбросом в канализационную систему подлежат обязательному химическому или термическому обеззараживанию.
2.3.24. Помещения блока для работы и содержания инфицированных животных, боксированные помещения, микробиологические комнаты, должны быть оборудованы автономными системами приточно-вытяжной вентиляции с механическим побуждением, оснащенными фильтрами тонкой очистки на выходе, проверяемыми на защитную эффективность, или боксами биологической безопасности II класса. В отдельных случаях, для создания асептических условий в помещениях, фильтрами тонкой очистки могут оснащаться и приточные системы вентиляции.
2.3.25. Эксплуатацию систем приточно-вытяжной вентиляции лабораторий (лабораторных зданий) должны осуществлять в соответствии с инструкцией, составленной на основании требований соответствующих нормативных документов.
2.3.26. Смена фильтров должна проводиться при нарушении параметров депрессионного режима (изменение скорости воздушных потоков, кратности воздухообмена), при повреждении фильтра (снижение сопротивления, увеличение коэффициента проскока), при повышении сопротивления фильтров на 50% и одновременно уменьшении скорости воздушного потока в боксирующих устройствах.
2.3.27. Для поддержания нормируемых параметров микроклимата могут быть установлены кондиционеры в рабочих комнатах и боксированных помещениях. На время работы с ПБА кондиционеры должны быть выключены. Фильтрующие элементы кондиционеров должны периодически (не реже 1 раза в 3 месяца) подвергаться очистке от механических частиц и дезинфекции. Не допускается установка кондиционеров в комнатах для содержания зараженных животных.
2.3.28. Все вакуумные линии, линии сжатого воздуха и газов в «заразной» зоне лабораторных помещений должны быть обеспечены фильтрами тонкой очистки воздуха.
2.3.29. Не допускается подводка систем горячего и холодного водоснабжения и канализации в микробиологические боксы.
2.3.30. Для обеспечения физической защиты работающего персонала, воздуха и поверхностей рабочей зоны, окружающей среды от исследуемых микроорганизмов должны использоваться боксы биологической безопасности.
2.3.31. Для работы с ПБА должны применяться боксы биологической безопасности II класса.
Все работы в боксах биологической безопасности проводят на поддонах с салфетками, смоченными дезинфицирующим раствором.
Помещения для исследований на кишечные протозоозы и гельминтозы должны быть оборудованы вытяжным шкафом.
2.3.32. Работы, связанные с высоким риском образования аэрозоля (центрифугирование, гомогенизация, измельчение, интенсивное встряхивание, обработка ультразвуком, вскрытие объектов с зараженным материалом), работы с большими объемами и высокими концентрациями ПБА и др. при невозможности их осуществления в боксах биологической безопасности должны проводиться в отдельных боксированных помещениях.
2.3.33. Боксы биологической безопасности должны проверяться на защитную эффективность:
— после монтажа и подготовки к использованию;
— не реже одного раза в год при наличии фильтров предварительной очистки воздуха от крупнодисперсных частиц;
— не реже одного раза в полугодие при отсутствии фильтров предварительной очистки воздуха от крупнодисперсных частиц;
— после перемещения или ремонта бокса.
При проверке должны определяться эффективность работы фильтров очистки воздуха, скорость воздушного потока в рабочем проеме бокса.
2.4. Требования к проведению работ в лаборатории
2.4.1. Доставка в лабораторию материала для исследования осуществляется в контейнерах, биксах или в сумках-холодильниках. Доставляемые емкости с жидкими материалами должны быть закрыты пробками, исключающими выливание содержимого во время транспортирования. Дно контейнеров, содержащих емкости с ПБА, должно быть покрыто адсорбирующим материалом (марлевая салфетка, ткань, вата и пр.), контейнеры, боксы или сумки-холодильники должны быть промаркированы и иметь международный знак «Биологическая опасность». Не допускается доставка материала в хозяйственных сумках, чемоданах, портфелях и других предметах личного пользования.
2.4.2. Прием и разборка доставленного материала (проб) должны проводиться с соблюдением мер предосторожности. Емкости с ПБА должны помещаться на поднос или лоток, покрытый многослойной марлевой салфеткой, смоченной дезинфицирующим раствором. Персонал должен использовать маску и резиновые перчатки.
2.4.3. В боксированных помещениях «заразной» зоны лаборатории (или в боксах биологической безопасности) проводятся:
— работа с животными (заражение, вскрытие);
— содержание инфицированных животных;
— центрифугирование ПБА, сушка, дезинтеграция, другие операции с вероятным образованием аэрозоля;
— заражение культуры клеток и куриных эмбрионов;
— приготовление суспензий;
— работа с лиофилизированными ПБА;
— работа по ведению коллекционных штаммов;
— работа по идентификации и изучению выделенных штаммов микроорганизмов.
2.4.4. Во время работы двери боксов и предбоксов должны быть закрыты. Выход из боксов во время проведения работ не допускается. Бокс должен быть оснащен средствами аварийной сигнализации, а предбокс — средствами пожаротушения.
2.4.5. При использовании боксов биологической безопасности перед началом работы должна быть включена вентиляция. Направление и величину скорости движения воздуха в открытом проеме боксов II класса определяют при их установке и после проведения планово-предупредительного ремонта. Перед загрузкой исследуемого материала в рабочий объем бокса необходимо проверить исправность оборудования в боксе, наличие аварийного запаса дезинфицирующих средств. Вся работа должна выполняться ближе к задней стенке бокса биологической безопасности II класса и быть видимой снаружи. После удаления контейнеров с ПБА переднюю панель бокса биологической безопасности опускают, внутри бокса включают бактерицидные лампы.
2.4.6. Заражение животных в боксах проводится в присутствии двух человек.
2.4.7. При пипетировании необходимо пользоваться только резиновыми грушами или автоматическими устройствами.
2.4.8. Бактериологическая петля должна быть замкнута в непрерывное кольцо и иметь плечо длиной не более 6 см. Допускается использование одноразовых промышленно изготовленных петель с большей длиной плеча.
2.4.9. Перед использованием посуда, пипетки, оборудование, шприцы и т.д. должны быть проверены на целостность и исправность.
2.4.10. При исследованиях сывороток крови людей на обнаружение антигена или определение антител к возбудителям II группы патогенности:
— работа проводится в отдельном помещении (комната, бокс);
— работа проводится только с использованием неинфекционных антигенов (диагностикумов);
— отделение сыворотки крови центрифугированием должно проводиться в боксированном помещении или боксе биологической безопасности.
2.4.11. Работу по лиофилизации ПБА III-IV групп патогенности проводят в соответствии с действующей инструкцией.
2.4.12. Ампулы с высушенными культурами вскрывают в помещении музея (коллекции) живых культур в боксе биологической безопасности. При этом оттянутый конец ампулы нагревают над пламенем горелки, затем кусочком стерильной ваты, смоченным в стерильной воде, осторожно прикасаются к нему для образования трещины. Той же влажной ватой обводят вокруг носика ампулы. После образования круговой (или не полностью круговой) трещины конец ампулы накрывают трехслойной марлевой салфеткой, смоченной дезинфицирующим раствором и хорошо отжатой, и обламывают пинцетом. После вскрытия ампула остается накрытой в течение 1-2 минут. Затем салфетку снимают и вместе с остатками стекла погружают в дезинфицирующий раствор. Вскрытую ампулу накрывают стерильным марлевым тампоном на 1-2 минуты, затем в ампулу вносят раствор для приготовления взвеси, которую далее высевают на жидкие и твердые питательные среды.
2.4.13. По окончании работы все объекты, содержащие ПБА, должны быть убраны в хранилища (холодильники, термостаты, шкафы и т.д. ); в обязательном порядке проводится дезинфекция рабочих поверхностей столов.
2.4.14. Использованные пипетки полностью (вертикально) погружаются в дезинфицирующий раствор, избегая образования в каналах пузырьков воздуха.
2.4.15. Остатки ПБА, использованная посуда, твердые отходы из «заразной» зоны лаборатории должны собираться в закрывающиеся емкости и передаваться в автоклавную или дезинфицироваться на месте. Слив необеззараженных жидкостей в канализационную сеть запрещается.
2.4.16. Перенос ПБА и использованной посуды для обеззараживания должен осуществляться в закрывающихся емкостях с соответствующей маркировкой.
2.4.17. Пробирки и флаконы со сгустками крови обеззараживаются с использованием дезинфицирующих растворов или с применением физических методов дезинфекции с помощью оборудования, разрешенного для этих целей в установленном порядке. Вытряхивание необеззараженного сгустка крови из пробирки (флакона) запрещается. При погружении в дезинфицирующий раствор емкостей со сгустками крови необходимо соблюдать осторожность. Емкость берут анатомическим пинцетом так, чтобы одна его бранша вошла немного внутрь, и погружают ее в наклонном положении до полного заполнения раствором. При правильном погружении воздушные пузыри не образуются и емкость опускается на дно. После погружения всех емкостей пинцет обеззараживают.
2.4.18. После завершения работы помещение «заразной» зоны лаборатории запирается и опечатывается. При наличии коллекции культур микроорганизмов дополнительно опечатываются их хранилища. Опечатывание и снятие печатей производят сотрудники лаборатории, имеющие разрешение руководителя лаборатории (подразделения).
2.4.19. Хранение ПБА, их учет, передача, транспортирование и уничтожение проводятся в соответствии с требованиями действующих нормативных документов.
2.4.20. Прием посетителей, хранение пищевых продуктов, прием пищи разрешаются только в специально отведенных местах в «чистой» зоне лаборатории.
2.4.21. Вынос из лаборатории оборудования, лабораторной или хозяйственной посуды, реактивов, инструментов и др. производится только после их дезинфекции и с разрешения ее руководителя.
2.4.22. Использование материалов и средств личной гигиены, раздражающих кожу, не допускается.
2.4.23. В «заразной» зоне лаборатории не допускается:
— оставлять после окончания работы на рабочих местах нефиксированные мазки или посуду с ПБА;
— пипетировать ртом, переливать жидкий инфекционный материал через край сосуда (пробирки, колбы, флакона и др.);
— хранить верхнюю одежду, головные уборы, обувь, зонты, хозяйственные сумки, косметику и т.п. , а также продукты питания;
— курить, пить воду;
— оставлять рабочее место во время выполнения любого вида работ с ПБА;
— сливать жидкие отходы (инфицированные жидкости, исследуемый материал и т.д. ) в канализацию без предварительного обеззараживания;
— удалять необеззараженные сгустки крови из пробирок, флаконов вытряхиванием.
2.4.24. Допускается в одном и том же помещении поочередное проведение диагностических и экспериментальных исследований после проведения дезинфекции помещения, приборов и оборудования.
2.5. Требования к проведению производственных работ
2.5.1. Порядок работы в производственных помещениях при работе с культурами микроорганизмов III-IV групп патогенности устанавливают в соответствии с настоящими санитарными правилами, санитарными правилами «Надлежащая практика производства медицинских иммунобиологических препаратов. СП 3.3.2.1288-03» (зарегистрированы в Министерстве юстиции Российской Федерации 22 мая 2003 г., регистрационный N 4584), а также инструкцией по лиофильному высушиванию возбудителей инфекционных заболеваний I-IV групп патогенности.
2.6. Дополнительные требования при проведении работ с гидатидозным и альвеолярным эхинококками
2.6.1. Экспериментальные работы со стробилярной (ленточной) стадией гидатидозного и альвеолярного эхинококков разрешаются лишь в течение 2 недель с момента орального заражения животных протосколексами паразитов. Работы со зрелыми яйцами ленточной стадии указанных эхинококков должны проводиться в боксах биологической безопасности не ниже II класса.
2.7. Дополнительные требования при проведении работ с возбудителями туберкулеза
2.7.1. Работа с возбудителями туберкулеза и материалом, подозрительным на инфицированность возбудителем туберкулеза, осуществляется в соответствии с приложениями 1.9-1.11 к приказу Минздрава России от 21.03.2003 N 109 «О совершенствовании противотуберкулезных мероприятий в Российской Федерации» (не нуждается в госрегистрации Министерством юстиции Российской Федерации. Письмо Минюста России от 06.05.2003 N 07/4535-ЮД).
2.8. Требования к проведению работ с использованием аэрозольных камер
2.8.1. Аэрозольные камеры (установки) должны размещаться в боксированных помещениях «заразной» зоны. Непосредственно к боксу с аэрозольной камерой должны примыкать боксы для содержания инфицированных животных и их вскрытия. Все боксы должны сообщаться посредством передаточных шлюзов.
2.8.2. Боксы для размещения аэрозольной камеры, содержания животных и их вскрытия должны быть оборудованы механической приточно-вытяжной вентиляцией с фильтрами тонкой очистки воздуха, иметь дублирующий двигатель на вытяжке с автоматическим переключением. В них должно поддерживаться разряжение 2-4 мм водяного столба или вытяжка должна преобладать над притоком не менее чем на 15%.
2.8.3. После установки фильтры для очистки воздуха должны быть проверены на проскок и произведены замеры их сопротивления.
2.8.4. В период эксплуатации замеры сопротивления фильтров должны проводиться ежеквартально с отметкой в специальном журнале.
2.8.5. Смена фильтров должна проводиться при нарушении параметров депрессионного режима (изменение скорости воздушных потоков, кратности воздухообмена), при повреждении фильтров (снижение сопротивления, увеличение коэффициента проскока), при увеличении их сопротивления на 50% и одновременном уменьшении скорости воздушного потока в боксирующих устройствах.
2.8.6. Конструкция аэрозольной камеры должна обеспечивать постоянное разряжение внутри ее не менее 4 мм водяного столба и оборудована системой очистки (деконтаминации) воздуха.
2.8.7. Проверка аэродинамической установки на возможность проникновения аэрозоля в воздух помещения проводится ежегодно с применением тест-микробов.
2.8.8. Пусковые кнопки вентиляции должны быть оборудованы световым сигналом.
2.8.9. Внутренняя отделка боксов для установки аэрозольной камеры, содержания животных и их вскрытия (полы, стены, потолок) должны выдерживать систематическое проведение аэрозольной дезинфекционной обработки.
2.8.10. Работа на аэрозольной камере с зараженными животными должна проводиться в противочумном костюме IV типа (пижама или комбинезон, халат, носки, тапочки, шапочка) с использованием перчаток и ватно-марлевых повязок или респираторов типа «лепесток-200».
2.8.11. Защитная одежда должна сниматься и замачиваться в дезинфицирующем растворе в предбоксе.
2.8.12. Перед каждым проведением работ на аэрозольной установке должен быть проведен осмотр установки и системы вентиляции с составлением заключения об их готовности к работе.
2.8.13. В каждом подразделении должна быть составлена и утверждена руководителем учреждения подробная инструкция о порядке проведения работ на аэрозольной установке и с зараженными животными с учетом требований биологической безопасности, а также с изложением мероприятий, проводимых при локализации и ликвидации аварий.
2.9. Требования к порядку отлова, транспортирования и содержания диких позвоночных животных и членистоногих
2.9.1. Порядок отлова, транспортирования, вывоза и содержания диких позвоночных животных и членистоногих на энзоотичных территориях по чуме, геморрагическим лихорадкам и другим особо опасным природно-очаговым инфекциям изложен в санитарных правилах по безопасности работ с микроорганизмами I-II групп патогенности.
2.9.2. На неэнзоотичной территории по чуме и другим особо опасным природно-очаговым инфекциям отлов и содержание позвоночных животных и кровососущих членистоногих должен осуществляться при строгом соблюдении настоящих правил.
2.9.3. Перед началом работы по отлову диких позвоночных животных и членистоногих начальник эпидотряда (экспедиции) должен получить справку в территориальном органе Роспотребнадзора об отсутствии в районе предполагаемого отлова за последние три года эпизоотии и случаев заболевания людей природно-очаговыми инфекциями.
2.9.4. Ответственность за соблюдение правил биологической безопасности при проведении отлова диких животных и их содержания возлагается на руководителя (начальника) эпидотряда (экспедиции). Весь состав эпидотряда (экспедиции) должен быть ознакомлен с требованиями санитарных правил по биологической безопасности при работе с возбудителями природно-очаговых инфекций, циркулирующих на данной территории.
2.9.5. Диких животных и членистоногих, отловленных в природе, перед вывозом в научные и другие организации выдерживают в карантине. Карантинный виварий может быть организован на базе временного эпидотряда (экспедиции) или стационарной организации. Продолжительность карантина — 1 месяц.
2.9.6. Помещения карантинного вивария и инсектария должны быть изолированы от других помещений и защищены от проникновения грызунов и насекомых.
2.9.7. Ответственность за соблюдение правил безопасной работы в карантинном виварии и помещении для работы с членистоногими возлагается на начальника эпидотряда (экспедиции).
2.9.8. Доставленные в карантинный виварий зверьки должны быть освобождены от членистоногих и пересажены в чистые металлические или стеклянные банки с плотными сетчатыми крышками. Очес животных и уход за ними в течение карантина проводят с соблюдением требований биологической безопасности.
2.9.9. В случае обнаружения павшего зверька необходимо провести бактериологическое (вирусологическое) и серологическое исследование трупа.
2.9.10. При обнаружении инфекционного или паразитарного заболевания среди животных срок карантина продлевают на один месяц, считая со дня регистрации гибели последнего животного. В случае массового падежа всех животных забивают, а виварий тщательно дезинфицируют.
2.9.11. Трупы павших или забитых животных обеззараживают.
2.9.12. Здоровых животных по истечении срока карантина транспортируют к месту дальнейшего использования.
2.9.13. Членистоногих содержат в специальном помещении (инсектарии) в садках или банках, исключающих их рассеивание.
2.9.14. Посуду и инструменты, применяемые при работе с членистоногими, дезинфицируют.
2.9.15. В виварии и инсектарии учет движения диких позвоночных животных и членистоногих ведут в специальном журнале с указанием места и даты вылова, результатов исследования и карантинизации.
2.9.16. Передача диких позвоночных животных и членистоногих из вивария или инсектария в другие учреждения возможна только по разрешению руководителя организации. Разрешается выдача животных только из числа родившихся в чистом виварии.
2.10. Требования к проведению зоологической и энтомологической работы
2.10.1. Орудия лова и другой инструмент, соприкасающийся в процессе работы с грызунами и членистоногими (капканы, давилки, ленты для вылова эктопаразитов, пробирки, мешочки и т.д. ), следует перевозить и переносить в закрытой таре. Доставку орудий лова и полевого материала в лабораторию осуществляют специально выделенным транспортом в сопровождении лица, знакомого с требованиями биологической безопасности. Хранить орудия лова, так же как и добытый полевой материал, необходимо в специальных местах, недоступных для посторонних лиц.
2.10.2. Добытых зверьков при необходимости умерщвляют непосредственно в капкане путем сдавливания шеи корнцангом или тигельными щипцами. Трупы для безопасности транспортирования складывают в бязевые мешочки, а последние — в отсадники, ящики или брезентовые (клеенчатые) мешочки. Бязевые мешочки для исключения рассеивания членистоногих плотно завязывают дважды (второй раз через подвернутый край мешочка) и доставляют в лабораторию для исследования.
2.10.3. Живых грызунов помещают в металлические или обитые изнутри оцинкованным железом отсадники или ящики. Членистоногих для паразитологического и микробиологического исследования доставляют в пробирках, закрытых ватно-марлевыми пробками, помещенных в металлические пеналы, или в толстостенных стеклянных флаконах с притертыми пробками, помещенных в бязевые мешочки.
2.10.4. Грызунов, добытых мертвыми, после освобождения из мешочков очесывают, добытых живыми обрабатывают инсектицидами в отсадниках.
2.10.5. Дезинсекцию и дезинфекцию бязевых мешочков, в которых были доставлены зверьки и прочий материал, производят после каждого их использования (приложение).
2.10.6. Дезинфекцию орудий лова и других инструментов проводят ежедневно по окончании работы.
2.10.7. Определение вида членистоногих, лабораторное исследование (приготовление суспензии, ее посев) проводят в комнате для зооэнтомо-логических работ. Членистоногих перед определением иммобилизуют парами эфира, раскладывают на широком предметном стекле и просматривают в сухом виде под микроскопом. При рассмотрении членистоногих живыми в капле воды под покровным стеклом предметное стекло помещают в чашку Петри для исключения загрязнения столика микроскопа стекающей со стекла жидкостью. После окончания работы чашки Петри и стекла погружают в дезинфицирующий раствор. Во избежание разбрызгивания жидкости при приготовлении суспензии клещей их необходимо перед растиранием разрезать ножницами под прикрытием крышки от чашки Петри или большой воронки.
2.10.8. Съемку шкурок и приготовление коллекционных тушек со зверьков, пойманных в районах, где возможна или протекает эпизоотия, проводят следующим образом:
2.10.8.1. При изготовлении коллекционных тушек для учебных целей зверьков необходимо предварительно выдержать в 10-процентном растворе формалина. Время экспозиции определяется исходя из размера зверька и скорости проникновения формалина в ткани (1 см в сутки); работу с фиксированными в формалине зверьками можно проводить в любом служебном помещении; защитный костюм не регламентируется.
2.10.8.2. При изготовлении тушек для научных целей, когда воздействие формалина недопустимо, зверька перед съемкой шкурки опускают на 10-15 мин. в 5-процентный раствор лизола, а снятую шкурку снова опускают на 3 ч в раствор лизола, после чего очищают ее от жира, обмывают и обрабатывают с внутренней стороны мышьяковистым натрием; череп либо выдерживают в формалине, либо дезинфицируют кипячением. Снятие шкурки с грызуна проводят с соблюдением требований биологической безопасности в помещении для работы с зараженными животными.
2.11. Требования к порядку использования рабочей одежды и средств индивидуальной защиты (СИЗ)
2.11.1. Сотрудники лабораторий должны быть обеспечены рабочей одеждой: медицинскими халатами, пижамами (комбинезонами), шапочками, сменной обувью и средствами индивидуальной защиты в зависимости от характера выполняемых работ и в соответствии с действующими нормами.
2.11.2. Рабочая одежда и обувь должны быть индивидуальными, соответствовать размерам работающих и храниться отдельно от личной одежды.
2.11.3. При выполнении исследований в боксированных помещениях производится смена медицинского халата на противочумный или хирургический, доходящий до нижней трети голени. Дополнительно используются резиновые перчатки, тапочки и, при необходимости, респираторы (маски).
2.11.4. При приготовлении суспензий органов, при заражении животных и при работе с кровью дополнительно к СИЗ, указанным в п. 2.11.3, используется защитный экран или очки.
2.11.5. Смена рабочей одежды должна проводиться по мере загрязнения, но не реже 1 раза в неделю.
2.11.6. Перед сдачей в стирку защитная одежда должна быть обеззаражена.
2.11.7. Работники, проводящие отлов грызунов, сбор членистоногих, а также другие полевые работы с дикими позвоночными животными и членистоногими, должны быть обеспечены соответствующей сезону рабочей, а также защитной одеждой.
2.12. Требования к проведению дезинфекции различных объектов и уборке помещений. Средства и методы
2.12.1. Дезинфекцию различных объектов при работе с ПБА III — IV групп патогенности осуществляют физическим (кипячение, водяной насыщенный пар под избыточным давлением, сухой горячий воздух, УФ-облучение), химическим (использование растворов дезинфицирующих средств) и биологическими (биологические овициды) методами. Для дезинфекции допускается использование только дезинфицирующих средств и дезинвазионных (биологических овицидов) средств и оборудования (дезинфекционные камеры, паровые и воздушные стерилизаторы, распыливающие устройства, установки, бактерицидные облучатели, моечные машины, бактериальные фильтры, стерилизационные коробки и т.д. ), разрешенных в установленном порядке к промышленному выпуску и применению в Российской Федерации. Методы и средства обеззараживания определяются в каждом отдельном случае в зависимости от ПБА и характера обеззараживаемого материала.
2.12.2. При проведении дезинфекции предпочтение следует отдавать физическому методу вследствие его надежности и безопасности для персонала.
2.12.3. Дезинфекцию с использованием физического метода выполняют:
— паровым методом (в паровом стерилизаторе);
— воздушным методом (в воздушном стерилизаторе);
— паровоздушным методом (в дезинфекционной камере);
— УФ-облучением;
— токами сверхвысокой частоты (СВЧ) (для отходов).
Допускается кипячение в воде или в воде с добавлением натрия двууглекислого (сода пищевая) в дезинфекционном кипятильнике.
2.12.4. Дезинфекции способом кипячения подвергают посуду, в том числе лабораторную, белье, защитную одежду персонала, перчатки резиновые, резиновые шланги, пробки, груши для пипетирования зараженного материала, инструменты после вскрытия лабораторных животных, жидкие отходы, смывные воды, уборочный материал, мешочки для транспортирования диких грызунов и др.
2.12.5. Паровым методом обеззараживают посуду лабораторную, защитную одежду персонала, бактериологические посевы, банки и бачки для животных, подстилочный материал, выделения животных, остатки корма, металлические садки, бачки из-под вскрытых животных и орудия лова, воздушные бактериальные фильтры, трупы животных, жидкие отходы, смывные воды.
2.12.6. Дезинфекции воздушным методом подвергают лабораторную посуду из стекла, металлов, силиконовой резины без упаковки. Этим методом дезинфицируют посуду, не загрязненную органическими веществами.
2.12.7. Паровоздушным методом в дезинфекционных камерах обрабатывают ватные куртки, брюки, постельные принадлежности, полушубки, шапки, кожаную и меховую обувь, тапочки.
2.12.8. С использованием дезинфицирующих средств проводят обеззараживание ограниченных участков почвы, поверхностей в помещениях, мебели, оборудования, защитной одежды персонала, белья, перчаток резиновых, очков, обуви, посуды лабораторной (пипетки, пробирки, колбы, чашки Петри, предметные стекла, гребенки для сушки культур, шприцы и др.), инструментов, в том числе после вскрытия лабораторных животных, металлических ящиков, садков, бачков из-под вскрытых животных и орудий лова, воздушных фильтров, подстилочного материала, жидких отходов, смывных вод, выделений больного (мокрота, моча, фекалии), посуды из-под выделений больного, санитарно-технического оборудования, уборочного материала, мусорных ящиков, транспорта. Для дезинфекции применяют средства, содержащие в качестве действующих веществ (ДВ) активный кислород (перекисные соединения и др.), катионные поверхностно-активные вещества (КПАВ), хлорактивные соединения, альдегиды, спирты (этанол, пропанол и др.) чаще всего в виде многокомпонентных рецептур, содержащих одно или несколько ДВ и функциональные добавки (антикоррозионные, дезодорирующие, моющие и др.).
Режимы дезинфекции различных объектов, контаминированных возбудителями III-IV групп патогенности (бактериями, включая микобактерии, вирусами, грибами и спорами бацилл) дезинфицирующими средствами приведены в инструкциях по их применению.
2.12.9. Выбор дезинфицирующего средства определяется спецификой объектов, подлежащих обеззараживанию, и целевым назначением средства. При проведении текущей и генеральной уборок с применением растворов ДС поверхности в помещениях, приборов, оборудования и др. дезинфицируют способом протирания тканевой салфеткой или ветошью, смоченными раствором ДС. Для этих целей целесообразно использовать дезинфицирующие средства с моющим эффектом. При необходимости экстренной обработки в течение рабочего дня небольших по площади или труднодоступных поверхностей возможно применение готовых форм ДС, например, на основе спиртов, для которых характерно короткое время воздействия, с помощью ручных распылителей или способом протирания растворами ДС, нанесенными на ветошь, или готовыми к применению дезинфицирующими салфетками. Применение ДС с моющими свойствами позволяет объединить обеззараживание объекта с его мойкой, поэтому при проведении текущих и генеральных уборок применяют ДС, обладающие моющим действием. Для дезинфекции выделений (фекалии, мокрота и др.) и посуды из-под выделений используют в основном хлорактивные средства. Для дезинфекции столовой посуды, спецодежды и белья используют средства, не содержащие альдегидов, спиртов. Для дезинфекции изделий медицинского назначения и лабораторной посуды применяются средства на основе альдегидов, катионных поверхностно-активных веществ, перекиси водорода, хлорсодержащие средства. Дезинфекцию изделий и посуды проводят способом погружения в раствор дезинфицирующего средства. Разъемные изделия дезинфицируют в разобранном виде. Каналы и полости изделий заполняют дезинфицирующим раствором. Для дезинфекции металлических ящиков, садков, бачков из-под вскрытых животных и орудий лова используют средства на основе альдегидов, катионных поверхностно-активных веществ, перекиси водорода, спиртов, хлорсодержащие средства. Дезинфекцию проводят способами протирки в соответствии с режимами, рекомендованными для обеззараживания поверхностей, или способом погружения — в соответствии с режимами, рекомендованными для обеззараживания изделий медицинского назначения в инструкциях по применению средств.
2.12.10. Обеззараживание медицинских отходов классов Б и В (белье, маски, спецодежда, салфетки, изделия медицинского назначения однократного применения и др.) перед утилизацией осуществляют в местах их образования способом погружения в растворы ДС в соответствии с санитарными правилами и нормами «Правила сбора, хранения и удаления отходов лечебно-профилактических учреждений». Для дезинфекции медицинских отходов применяют химический и физический методы обеззараживания по режимам, обеспечивающим гибель соответствующих возбудителей. Дезинфекция выделений, крови, мокроты и др. проводится также сухими хлорактивными ДС (хлорная известь, кальция гипохлорит нейтральный и пр.). Возможно одновременное обеззараживание и утилизация медицинских отходов с использованием установок, разрешенных к применению в установленном порядке.
2.12.11. В лаборатории должен храниться как минимум недельный запас дезинфицирующих средств.
2.12.12. Вновь поступающие на склад партии дезинфицирующих средств необходимо контролировать на содержание действующего вещества.
2.12.13. Дезинфицирующие растворы готовят в специально отведенных помещениях или вытяжном шкафу. На емкости с дезинфицирующим раствором должны быть указаны его название, концентрация и дата приготовления.
2.12.14. Автоклавирование проводится персоналом, имеющим свидетельство об окончании специальных курсов. Контроль работы паровых и воздушных стерилизаторов, используемых для обеззараживания материалов, проводят согласно действующим инструктивно-распорядительным и методическим документам физическим, химическим и биологическим методами. Бактериологический контроль работы стерилизаторов проводят после монтажа и ремонта аппаратуры, а также в процессе его эксплуатации (плановый — 2 раза в год и при получении неудовлетворительных результатов контроля).
2.12.15. Перенос материала для обеззараживания внутри подразделения проводится в специальных емкостях (баках, ведрах, биксах с крышками).
2.12.16. Текущая уборка помещений проводится ежедневно влажным способом после окончания рабочего дня: в «чистой» зоне лаборатории с применением моющих средств, в «заразной» зоне с применением дезинфектантов. При дезинфекции объектов, загрязненных кровью и другими биологическими субстратами, представляющими опасность в распространении парентеральных вирусных гепатитов и ВИЧ-инфекции, следует руководствоваться действующими инструктивно-методическими документами и применять ДС по противовирусному режиму. В боксовых помещениях проводится еженедельная генеральная уборка помещений с применением дезинфицирующих средств. Поверхности в помещениях, аппараты, приборы протирают дезинфицирующим раствором, стены обрабатывают на высоту до 2 метров. После влажной уборки включают бактерицидные лампы. Эксплуатация бактерицидных облучателей должна осуществляться в соответствии с действующими методическими документами по применению бактерицидных ламп для обеззараживания воздуха и поверхностей в помещениях, утвержденными в установленном порядке. Стеклянные поверхности бактерицидных ламп следует протирать в выключенном положении ветошью, смоченной спиртом, не реже 1 раза в неделю.
2.12.17. Уборочный инвентарь должен быть промаркирован отдельно для «чистой» и «заразной» зон. Перенос его из одной зоны в другую не допускается.
2.12.18. По окончании работ медицинский персонал должен обработать руки дезинфицирующим раствором или 70% спиртом с последующим мытьем с мылом. Допускается использование кожных антисептиков в соответствии с инструкциями по применению.
III. Требования к порядку действий по ликвидации аварий при работе с патогенными биологическими агентами
3.1. На случай аварии, при которой создается реальная или потенциальная возможность выделения патогенного биологического агента в воздух производственной зоны, среду обитания человека и заражения персонала, в подразделениях, где ведут работы с ПБА, должен быть план ликвидации аварии, запас дезинфицирующих средств, активных в отношении возбудителей, с которыми проводят исследования. В подразделении, проводящем работу с ПБА, в специально отведенном месте хранят гидропульт (автомакс), комплекты рабочей (для переодевания пострадавших) и защитной (для сотрудников, ликвидирующих последствия аварии) одежды, аварийную аптечку. В состав аварийной аптечки входит: спирт этиловый 70% (два флакона по 100 мл), 2-3 навески перманганата калия для приготовления 0,05% раствора (0,0125 г перманганата калия + 25 мл воды), стерильная дистиллированная вода, 5% настойка йода, ножницы с закругленными браншами, перевязочные средства (вата, бинты и пр.), жгут и нашатырный спирт. Кроме выше перечисленного, в аптечке вирусологической лаборатории должны быть 1% раствор борной кислоты, интерферон или индуктор интерферона; в аптечке микологической лаборатории — 1 % раствор борной кислоты или навески для приготовления раствора (0,25 г борной кислоты + 25 мл воды). В лабораториях научно-исследовательских институтов, проводящих исследования с микроорганизмами III-IV групп патогенности с измененными свойствами, должен быть запас средств для экстренной профилактики и лечения (антибиотики, сыворотки, иммуноглобулины и др.) на 2-4 человек. Ответственным за комплектование аптечки экстренной медицинской помощи является руководитель подразделения.
3.2. Объем мероприятий по ликвидации аварии зависит от характера выполняемой работы, вида и свойств возбудителя, масштабов аварии:
— авария с разбрызгиванием ПБА, т.е. с образованием аэрозоля (бой пробирок, флаконов или колб с жидкой культурой; бой чашек и пробирок с культурами на агаре с конденсатом; разбрызгивание бактериальной суспензии из пипетки или шприца; разбрызгивание тканевой жидкости при вскрытии трупов зараженных животных или больных людей; аварии на вакуумной установке в процессе сушки вирулентных культур, а также другие аварии, ведущие к контаминации воздуха или окружающих предметов, например, авария при транспортировании ПБА в автоклавную и между подразделениями);
— авария без разбрызгивания ПБА (касание петлей с инфицированным материалом края чашки, пробирки, флакона, кристаллизатора, трещина на чашке Петри, пробирке, флаконе с биологическим материалом, падение на стол твердой частицы при обжигании петли после посева, касание поверхности посева на твердой питательной среде и т.п. );
— авария, связанная с нарушением целостности кожных покровов.
3.3. Порядок действий сотрудников при аварии:
3.3.1. При аварии с разбрызгиванием ПБА:
— все находящиеся в помещении лица немедленно прекращают работу и, задержав дыхание, выходят из заразного помещения в предбокс, плотно закрывают дверь, включают аварийную сигнализацию и сообщают о случившемся руководителю подразделения;
— руки обрабатывают дезинфицирующим раствором или спиртом, если лицо не было защищено, то его обильно обрабатывают 70% этиловым спиртом;
— слизистые глаз, носа и рта обрабатывают препаратами из аварийной аптечки; рот и горло прополаскивают 70% этиловым спиртом, в нос закапывают раствор марганцовокислого калия 1:100 000 или 1% раствор борной кислоты, а при аварии с вирусами затем закапывают интерферон или индуктор интерферона;
— защитную одежду снимают, погружают в дезинфицирующий раствор или помещают в бикс (бак) для автоклавирования;
— открытые части тела протирают 70% этиловым спиртом;
— в глаза (можно и в нос) закапывают растворы антибиотиков или других средств, к которым чувствителен возбудитель;
— принимают гигиенический душ;
— надевают чистую рабочую одежду.
Порядок проведения дезинфекционных мероприятий:
— сотрудники, участвующие в ликвидации аварии, должны быть одеты в противочумный (хирургический) халат, косынку, галоши (пластиковые бахилы);
— при проведении дезинфекции способом орошения в качестве СИЗ органов дыхания используются респираторы марки РУ-60 М или РПГ-68 с патроном, соответствующим применяемому дезинфектанту, или противогаз типа ГП-5;
— для обработки используют дезинфицирующий раствор, эффективный в отношении соответствующего инфекционного агента;
— дезинфекцию помещения проводят, разбрызгивая из гидропульта (автомакса) дезинфицирующий раствор от входной двери и далее, продвигаясь по обработанной территории и орошая перед собой все предметы (пол, стены, потолок) и воздушную среду;
— через 2 часа после первичной обработки собирают тампонами, смоченными дезинфицирующим раствором, осколки разбитой посуды, погружая их в емкость с дезинфицирующим раствором; лабораторную посуду с посевами, находившуюся в момент аварии на рабочих поверхностях, погружают в емкость с дезинфицирующим раствором или обтирают салфеткой, смоченной дезинфицирующим раствором, и помещают в емкость для автоклавирования;
— по окончании дезинфекции воздух и поверхности в помещении обеззараживают бактерицидными лампами по режимам согласно нормативным документам;
— сотрудник, проводивший дезинфекционную обработку, выходит в предбокс или коридор, снимает защитную одежду, погружая ее в дезинфицирующий раствор;
— спустя два часа проводят уборку помещения, после чего работа может быть возобновлена.
3.3.2. При аварии без разбрызгивания ПБА:
— не выходя из помещения накладывают тампон с дезинфицирующим раствором на место контаминации ПБА поверхности объекта;
— включают аварийную сигнализацию, вызывают руководителя подразделения или лицо, его замещающее, и продолжают дезинфекционную обработку места аварии;
— после окончания дезинфекционной обработки сотрудник выходит из помещения, где произошла авария, снимает и погружает в дезинфицирующий раствор защитную одежду;
— открытые части тела обрабатывают дезинфицирующим раствором или 70% спиртом.
3.3.3. При аварии, связанной с нарушением целостности кожных покровов:
— работу прекращают;
— включают аварийную сигнализацию;
— руки обрабатывают дезинфицирующим раствором, снимают перчатку и выдавливают из ранки кровь в дезинфицирующий раствор;
— на место ранения ставят на 4-5 мин. компресс из дезинфицирующего раствора или 70% этилового спирта;
— при работе с вирусами кровь выдавливают в сухую стерильную салфетку и обрабатывают ранку 5% настойкой йода без применения дезинфицирующего раствора.
3.3.4. При аварии во время работы на центрифуге крышку медленно открывают только через 30-40 мин. (после оседания аэрозоля). Центрифужные стаканы и разбитое стекло помещают в дезинфицирующий раствор, поверхность крышки, внутренние части центрифуги, ее наружную поверхность дезинфицируют. Дезинфекция центрифуги проводится после отключения ее от электросети.
3.4. По сигналу «авария» любой сотрудник, принявший сигнал, немедленно извещает о случившемся руководителя подразделения или замещающего его специалиста. Руководитель подразделения сообщает об аварии комиссии по контролю соблюдения требований биологической безопасности и руководителю организации.
3.5. Руководитель подразделения и представитель комиссии по контролю соблюдения требований биологической безопасности оценивают ситуацию, определяют объем мероприятий по локализации и ликвидации последствий аварии и докладывают руководителю организации, организуют и контролируют действия сотрудников, участвующих в ликвидации аварии.
3.6. О происшедшей аварии и проведенных мероприятиях руководитель лаборатории направляет докладную записку на имя руководителя организации и председателя комиссии по контролю за соблюдением требований биологической безопасности, в которой указывает час и дату происшедшей аварии, ее характер, перечисляет сотрудников, находившихся на месте аварии, в том числе лиц, проводивших дезинфекционные мероприятия, а также принятые меры.
3.7. После ликвидации аварии руководитель организации совместно с членами Комиссии по контролю соблюдения требований биологической безопасности оценивают объем и качество, в том числе с использованием лабораторных методов исследований, проведенных мероприятий по локализации или ликвидации аварии и принимают решение о возобновлении работ с микроорганизмами.
3.8. Во всех подразделениях, работающих с ПБА, не реже одного раза в год проводят плановые тренировочные занятия по ликвидации аварий.
IV. Организация контроля выполнения требований биологической безопасности
4.1. Санитарно-эпидемиологический надзор за выполнением требований настоящих правил в подразделениях, работающих с ПБА, осуществляют территориальные органы Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, учреждения и структурные подразделения федеральных органов исполнительной власти, осуществляющих государственный санитарно-эпидемиологический надзор на объектах обороны и иного специального назначения.
4.2. В организации, работающей с ПБА, создается комиссия по контролю соблюдения требований биологической безопасности.
4.3. Текущий контроль выполнения требований настоящих правил осуществляется руководителем лаборатории или лицом, назначенным приказом по организации.
Приложение N 1 (справочно)
Классификация микроорганизмов — возбудителей инфекционных заболеваний человека, простейших, гельминтов и ядов биологического происхождения по группам патогенности С изменениями и дополнениями от: 29 июня 2011 г.
Бактерии
I группа
1. Yersinia pestis — чумы
II группа
1. Bacillus anthracis — сибирской язвы
2. Brucella melitensis — бруцеллеза
Brucella melitensis biovar Abortus
Brucella abortus 1
Brucella melitensis biovar Canis
Brucella melitensis biovar Neotomae
Brucella melitensis biovar Ovis
Brucella melitensis biovar Suis
3. Francisella tularensis — туляремии
4. Burkholderia mallei — сапа
5. Burkholderia pseudomallei — мелиоидоза
6. Vibrio cholerae O1 токсигенный — холеры
7. Vibrio cholerae non O1 (O139) токсигенный — холеры
8. Escherichia coli О157:H7, О104:Н4 и другие серотипы — продуценты веротоксина — геморрагического колибактериоза, гемолитико-уремического синдрома
III группа
1. Bordetella pertussis — коклюша
2. Borrelia recurrentis — возвратного тифа
3. Campylobacter fetus — абсцессов, септицемий
4. Campylobacter jejuni — энтерита, холецистита, септицемий
5. Clostridium botulinum — ботулизма
6. Clostridium tetani — столбняка
7. Corynebacterium diphtheria — дифтерии
8.Исключен
9. Erysipelothrix rhusiopathiae — эризипелоида
10. Helicobacter pylori — гастрита, язвенной болезни желудка и 12-перстной кишки
11. Legionella pneumophila — легионеллеза
12. Leptospira interrogans — лептоспироза
13. Listeria monocytogenes — листериоза
14. Mycobacterium leprae — проказы
15. Mycobacterium tuberculosis
Mycobacterium bovis — туберкулеза
Mycobacterium avium
16. Neisseria gonorrhoeae — гонореи
17. Neisseria meningitides — менингита
18. Nocardia asteroids — пневмонии, абсцессов мозга,
Nocardia brasiliensis — менингоэнцефалитов, менингитов, сепсисов, остеомиелитов
19. Pasteurella multocida — пневмонии, менингитов и др.
20. Proactinomyces israelii — актиномикоза
21. Salmonella paratyphi A — паратифа A
22. Salmonella paratyphi B — паратифа B
23. Salmonella typhi — брюшного тифа
24. Shigella spp — дизентерии
25. Treponema pallidum — сифилиса
26. Yersinia pseudotuberculosis — псевдотуберкулеза
27. Vibrio cholerae O1 не токсигенный — диареи
28. Vibrio cholerae non O1 (O139) не токсигенный — диареи, раневых инфекций, септицемии и др.
IV группа
1. Aerobacter aerogenes — энтерита
2. Bacillus cereus — пищевой токсикоинфекции
3. Bacteroides spp. — сепсиса, гнойных инфекций головы и шеи, гнойных инфекций ЦНС, стоматоинфекций, гнойных плевритов, гнойных инфекций мягких тканей, параректальных абсцессов, декубитальных язв, язв стопы, остеомиелитов, внутриабдоминальных инфекций
4. Borrelia spp — клещевого спирохетоза
5. Bordetella bronchiseptica — бронхосептикоза
Bordetella parapertussis — паракоклюша
6. Branchamella catarralis — воспалительных заболеваний нижних и верхних дыхательных путей, хронических бронхитов, уретритов, эндокардитов, менингитов
7. Burkholderia cepacia — местных воспалительных процессов и сепсиса
8. Burkholderia thailandensis — местных воспалительных процессов
9. Campylobacter spp. — гастроэнтерита, гингивита, периодонтита
10. Citrobacter spp. — местных воспалительных процессов, пищевой токсикоинфекции
11. Clostridium perfringens
Clostridium novyi
Clostridium septicum — газовой гангрены
Clostridium histolyticum
Clostridium bifermentans
12. Eikinella corrodens — перитонзиллярных абсцессов, абсцессов мозга
13. Escherichia coli — энтерита
14. Eubacterium endocarditidis — септического эндокардита
15. Eubacterium lentum — вторичных септицемий,
Eubacterium ventricosum — абсцессов
16. Enterococcus faecalis — эндокардитов хронических
Enterococcus faecium — обструктивных бронхитов, раневых инфекций, септицемий
17. Flavobacterium meningosepticum — менингита, септицемий
18. Haemophilus influenza — менингита, пневмонии, ларингита
19. Hafnia alvei — холецистита, цистита
20. Klebsiella ozaenae — озены
21. Klebsiella pneumonia — пневмонии
22. Klebsiella rhinoscleromatis — риносклеромы
23. Mycobacterium spp.
Photochromogens
Scotochromogens — микобактериозов
Nonphotochromogens
Rapid growers
24. Micoplasma genitalium — воспалительных процессов урогенитального тракта, осложнения беременности
Micoplasma hominis
Micoplasma urealyticum
Micoplasma pneumoniae — воспалительных заболеваний верхних дыхательных путей, пневмонии
25. Propionibacterium avidum — сепсиса, абсцессов
26. Proteus spp. — пищевой токсикоинфекции, сепсиса, местных воспалительных процессов
27. Pseudomonas aeruginosa — местных воспалительных процессов, сепсиса
28. Salmonella spp. — сальмонеллезов
29. Serratia marcescens — местных воспалительных процессов, сепсиса
30. Staphylococcus spp. — пищевой токсикоинфекции, септицемии, пневмонии
31. Streptococcus spp. — сепсиса, тонзиллита, пневмонии, менингита, гломерулонефрита, эндокардита, ревматизма, гнойных инфекций челюстно-некротизирующих фасцитов, миозитов, синдрома токсического шока, скарлатины, зубного кариеса, импетиго, рожистых воспалений
32. Vibrio spp. — диарей, пищевых токсикоинфекций, раневых инфекций, септицемий и т.д.
Vibrio parahaemolyticus
Vibrio mimicus
Vibrio fluvialis
Vibrio vulnificus
Vibrio alginolyticus
33. Yersinia enterocolitica — энтерита, колита
34. Actinomyces albus — актиномикоза
Риккетсии
II группа
1. Rickettsia prowazeki — эпидемического сыпного тифа и болезни Брилля
2. Rickettsia typhi — крысиного сыпного тифа
3. Rickettsia rickettsii — пятнистой лихорадки
4. Rickettsia tsutsugamushi — лихорадки цуцугамуши
5. Coxiella burnetii — коксиеллеза (лихорадки Ку)
III группа
1. Rickettsia sibirica — клещевого сыпного тифа Северной Азии
2. Rickettsia conorii — средиземноморской пятнистой лихорадки
3. Rickettsia sharoni — израильской лихорадки
4. Rickettsia sp.now? — «астраханской лихорадки»
5. Rickettsia akari — везикулезного риккетсиоза
6. Rickettsia australis — клещевого сыпного тифа Северного Квинсленда
7. Rickettsia japonica — японской пятнистой лихорадки
8. Rickettsia sp.now? — «африканской лихорадки»
9. Rickettsia sp.now? — «клещевого риккетсиоза штамм «ТТТ» Таиланда»
Эрлихи (подсемейство Ehrlichiae, семейство Rickettsiaceae)
III группа
1. Ehrlichia sennetsu — болезни сеннетсу
2. E.canis — название отсутствует
3. E.chaffeensis — название отсутствует
Вирусы
(В связи с отсутствием биноминальной номенклатуры для вирусов обозначения даются в русской транскрипции)
I группа
1. Filoviridae:
вирусы Марбург и Эбола — геморрагических лихорадок
2. Arenaviridae:
вирусы Ласса, Хунин, Мачупо, Себиа, Гуанарито — геморрагических лихорадок
3. Poxviridae:
Род Ortopoxvirine
вирус натуральной оспы (Variola) — натуральной оспы человека
вирус оспы обезьян (Monkeypox) — оспы обезьян
4. Herpesviridae:
обезьяний вирус B — хронического энцефалита и энцефалопатии
II группа
1. Togaviridae:
вирусы лошадиных инцефаломиелитов (Венесуэльский ВНЭЛ, Восточный ВЭЛ, Западный ЗЭЛ) -комариных энцефалитов, энцефаломиелитов, энцефаломенингитов
вирусы лихорадок Семлики, Бибару, Эвергладес, Чикунгунья, О’Ньонг-Ньонг, Карельской, Синдбис, реки Росс, Майяро, Мукамбо, Сагиума — лихорадочных заболеваний
2. Flaviviridae:
вирусы комплекса клещевого энцефалита (КЭ), Алма-Арасан, Апои, Лангат, Негиши, Повассан, Шотландского энцефаломиелита овец — энцефалитов, энцефаломиелитов
Болезни леса Киассанур, Омской геморрагической лихорадки (ОГЛ) — геморрагических лихорадок
вирусы комплекса японского энцефалита (ЯЭ), Западного Нила, Ильеус, Росио, Сент-Луис (энцефалиты), Усуту, (энцефалит), долины Муррея, Карши, Кунжин, Сепик, Вессельсборн — энцефалитов, менингоэнцефалитов
Зика, Риобраво, Денге, Сокулук — лихорадочных заболеваний
Желтой лихорадки — парентерального гепатита, гепатоцеллюлярной карциномы печени
3. Bunyaviridae,
Род Bunyavirus:
Комплекс Калифорнийского энцефалита, Ла Кросс, Джеймстаун каньон, зайцев-беляков, Инко, Тягиня — энцефалитов, энцефаломиелитов, менингоэнцефалитов и лихорадочных заболеваний с артритами
комплекс C-вирусы Апеу, Мадрид, Орибока, Осса, Рестан и др. — лихорадочных заболеваний с миозитами и артритами
Род Phlebovirus:
вирусы москитных лихорадок Сицилии, Неаполя, Рифт-валли, Тоскана и др. — энцефалитов и лихорадочных заболеваний с артритами и миозитами
Род Nairovirus:
вирус Крымской геморрагической лихорадки-Конго; — геморрагической лихорадки
болезни овец Найроби, Ганджам; — лихорадки с менингеальным синдромом
Дугбе — энцефалита
Род Hantavirus:
вирусы Хантаан, Сеул, Пуумала, Чили, Аидо и др. — геморрагических лихорадок с почечным синдромом (ГЛПС) и с легочным синдромом
4. Reoviridae,
Род Orbivirus:
вирусы Кемерово, колорадской клещевой лихорадки, Синего языка овец, Чангвинола, Орунго и др. — лихорадок с менингеальным синдромом и артритами
5. Rhabdoviridae,
Род Lyssavirus:
вирус уличного бешенства — бешенства
Дикования, Лагос-бат — псевдобешенства и энцефалопатий
6. Picornaviridae,
Род Aphtovirus:
вирус ящура — ящура
7. Arenaviridae:
вирусы лимфоцитарного хориоменингита, Такарибе, Пичинде — астенических менингитов и менингоэнцефалитов
8. Hepadnaviridae:
вирусы гепатита B — парентеральных гепатитов
9. Retroviridae:
вирусы иммунодефицита человека (ВИЧ-1, ВИЧ-2) — СПИДа
вирус Т-клеточного лейкоза человека (HTLV) — Т-клеточного лейкоза человека
10. Nodaviridae:
вирусы гепатитов D (дельта) и E — инфекционных гепатитов
11. Coronaviridae:
вирус SARS — ТОРС
12. Unconventional agents:
Возбудители медленных нейроинфекций — подострых губчатых энцефалопатий (Prion Diseases) Куру — подострой энцефалопатии
Агент CJD-возбудитель болезни — болезни Крейцфельда-Якоба,
Крейцфельда-Якоба синдрома Герстманна-Страусслера
Возбудитель трансмиссивной губчатой энцефалопатии человека — амиотрофического лейкоспонгиоза (Белоруссия)
Возбудитель оливопонтоцеребеллярной атрофии человека — оливопонтоцеребеллярной атрофии I типа (Якутия, Восточная Сибирь)
Скрепи — подострой энцефалопатии овец и коз
Возбудитель энцефалопатии норок — трансмиссивной энцефалопатии норок
Хроническая изнуряющая болезнь копытных — болезни хронической усталости оленей и лосей в неволе
Возбудитель губчатой энцефалопатии крупного рогатого скота — «коровьего бешенства»
III группа
1. Orthomyxoviridae:
вирусы гриппа A, B и C — гриппа
2. Picornaviridae,
Род Enterovirus:
вирусы полиомиелита — дикие штаммы — полиомиелита
вирусы гепатитов A и E — энтеральных гепатитов
вирус острого геморрагического конъюнктивита (АНС) — геморрагического конъюнктивита
3. Herpesviridae:
вирусы простого герпеса I и II типов — герпеса простого
герпесвирус зостор-ветрянки — ветряной оспы, опоясывающего герпетического лишая
вирус герпеса 6 типа (HBLv- HHv6) — поражение B-лимфоцитов человека родовой экзантемы, лимфопролиферативных заболеваний
вирус цитомегалии — цитомегалии
вирус Эпштейн-Барра — инфекционного мононуклеоза, лимфомы Беркитта, назофарингиальной карциномы
IV группа
1. Adenoviridae:
аденовирусы всех типов — ОРВИ, пневмоний, конъюнктивитов
2. Reoviridae,
Род Reovirus:
реовирусы человека — ринитов, гастроэнтеритов
Род Rotavirus:
ротавирусы человека, вирус диареи — гастроэнтеритов и энтеритов
телят Небраски (NCDV)
3. Coronaviridae:
коронавирусы человека — ОРВИ (профузного насморка без температуры), энтериты
4. Caliciviridae:
вирус Норфолк — острых гастроэнтеритов
5. Picornaviridae
Род Enterovirus
вирусы Коксаки группы A и B — серозных менингитов, энцефало-миокардитов, ОРВИ, болезни Борнхольма, герпангин, полиневритов
вирусы ECHO — серозных менингитов, диареи, ОРВИ, полиневритов, увеитов
энтеровирусы — типы 68-71 — серозных менингитов, конъюнктивитов, ОРВИ
Род Rinovirus:
риновирусы человека 130 типов — ОРВИ, полиневритов, герпангин, конъюнктивитов
Род Cardiovirus:
вирус энцефаломиокардита и вирус Менго — ОРВИ, полиневритов, энцефало-миокардитов, миокардитов, перикардитов
6. Paramyxoviridae:
вирусы парагриппа человека 1-4 типа — ОРВИ, бронхопневмоний
респираторно-синцитиальный вирус (РС-вирус) — пневмоний, бронхитов, бронхиолитов
вирус эпидемического паротита — эпидемического паротита
вирус кори — кори
вирус Ньюкаслской болезни — конъюнктивитов
7. Togaviridae,
Род Rubivirus:
вирус краснухи — краснухи
8. Rhabdoviride
Род Vesiculovirus:
вирус везикулярного стоматита — везикулярного стоматита
9. Poxviridae: вирус оспы коров — оспы коров
вирус эктромелии — эктромелии мышей
вирус узелков доильщиц — хронической болезни рук доильщиц
орфвирус — контагиозного пустулярного дерматита
вирус контагиозного моллюска — контагиозного моллюска кожи и слизистых
вирусы Тана и Яба — болезни Яба
Хламидии
II группа
1. Chlamydophila psittaci — орнитоза- пситтакоза
III группа
1. Chlamydia trachomatis — трахомы, урогенитального хламидиоза
2. Chlamydophila pneumoniae — пневмонии, артритов
Грибы
II группа
1. Blastomyces dermatitidis — бластомикоза
2. Coccidioides immitis Coccidioides posadasii — кокцидиоидомикоза
3. Histoplasma capsulatum var.capsulatum u duboisii — гистоплазмоза
4. Paracoccidioides brasiliensis — паракокцидиоидомикоза
III группа
1. Aspergillus flavus — аспергиллеза
Aspergillus fumigatus
Aspergillus terreus
2. Candida albicans — кандидоза
Candida glabrata
Candida crusei
Candida tropicalis
3. Cryptococcus neoformans — криптококкоза
4. Cladophialophora bantiana — феогифомикоза
5. Ramichloridium mackenzei — феогифомикоза
6. Penicillum marneffei — пенициллиоза
IV группа
1. Absidia spp. — зигомикоза
2. Acremonium spp. — гиалогифомикоза
3. Alternaria spp. — феогифомикоза
4. Aphanoascus fulvescens (анаморфа — Chrysosporium) — гиалогифомикоза
5. Apophysomyces elegans — зигомикоза
6. Aspergillus spp. — аспергиллеза
7. Aureobasidium pullulans — феогифомикоза
8. Basidiobolus spp. — зигомикоза
9. Beavueria bassiana — феогифомикоза
10. Botryomyces caespitosus — ботриомикоза
11. Candida spp. — кандидоза
12. Chaetomium spp. — феогифомикоза
13. Cladophialophora spp. — феогифомикоза
14. Cokeromyces recurvatus — зигомикоза
15. Conidiobolus spp. — зигомикоза
16. Cryptococcus spp. — криптококкоза
17. Cunnunghmella bertholletiae — зигомикоза
18. Curvularia spp. — феогифомикоза
19. Emmonsia spp. — адиаспиромикоза
20. Epidermophyton floccosum — дерматофитии
21. Exophiala spp. — феогифомикоза
22. Fonsecaea spp. — феогифомикоза, хромомикоза
23. Fusarium spp. — гиалогифомикоза
24. Geotrichum spp. — гиалогифомикоза
25. Graphium eumorphum — феогифомикоза
26. Gymnoascus dankalensis — онихомикоза
27. Histoplasma falciminosum — эпизоотического лимфангоита
28. Hoptaea werneckii — черной пьедры
29. Lacazia loboi — болезни Лобо
30. Leptosphaeria spp. — эумицетомы
31. Madurella spp. — эумицетомы
32. Malassezia spp. — малассезиоза
33. Microascus spp. — гиалогифомикоза
34. Microsporum spp. — дерматофитии
35. Mortierella wolfii — зигомикоза
36. Mucor spp. — зигомикоза
37. Nattrassia mangiferae (Scytalidium spp.) — онихомикоза
38. Neotestudina rosatii — эумицетомы
39. Ochroconis spp. — феогифомикоза
40. Onychocola spp. — онихомикоза
41. Paecilomyces spp. — гиалогифомикоза
42. Penicillium spp. — гиалогифомикоза
43. Phaeoacremonium spp. — феогифомикоза
44. Phialemonium spp. — феогифомикоза
45. Phialophora spp. — феогифомикоза
46. Phoma spp. — феогифомикоза
47. Piedraia hortae — черной пьедры
48. Pneumocystis carinii — пневмоцистоза
49. Pseudoallecheria boydii (Scedosporium apiospermum) — хромомикоза, эумицетомы
50. Pseudochaetosphaeronema larense — эумицетомы
51. Pyrenochaeta spp. — онихомикоза
52. Pythium insidiosum — питиоза
53. Ramichloridium spp. — феогифомикоза
54. Rhinocladiella aquaspersa — хромомикоза
55. Rhinosporidium seeberi — риноспоридиоза
56. Rhizomucor spp. — зигомикоза
57. Rhizopus spp. — зигомикоза
58. Saksenaea vasiformis — зигомикоза
59. Scedosporium profilicans — гиалогифомикоза
60. Scopulariopsis spp. — гиалогифомикоза
61. Sporothrix schenkii — споротрихоза
62. Syncephalastpum racemosum — зигомикоза
63. Trichoderma spp. — гиалогифомикоза
64. Trichophyton spp. — гиалогифомикоза
65. Trichosporon — дерматомикоза
66. Trichosporon — трихоспороноза
67. Ulocladium spp. — феогифомикоза
68. Wangiella dermatitidis — феогифомикоза
кроме видов, вошедших в III группу
Простейшие
III группа
1. Leishmania donovani — висцерального лейшманиоза
2. Pentatrichomonas (Trichomonas) hominis — кишечного трихомониаза
3. Plasmodium vivax
Plasmodium malariae — малярии
Plasmodium falciparum
Plasmodium ovale
4. Trichomonas vaginalis — мочеполового трихомониаза
5. Trypanosoma cruzi — американского трипаносомоза (болезни Шагаса)
6. Trypanosoma gambiense — африканского трипаносомоза (сонной болезни)
Trypanosoma rhodesiense
IV группа
1. Acanthamoeba spp. — менингоэнцефалита
2. Babesia caucasica — бабезиоза (пироплазмоза)
3. Balantidium coli — балантидиоза
4. Blastocystis hominis — колита
5. Cryptosporidium parvum — криптоспоридиоза
6. Cyclospora cayetanensis — циклоспороза
7. Entamoeba hystolytica — амебиаза
8. Isospora belli — изоспороза
9. Lamblia intestinalis (Giardia lamblia) — лямблиоза
10. Leishmania major — кожного лейшманиоза
Leishmania tropica
11. Naegleria spp. — менингоэнцефалита
12. Sarcocystis suihominis — саркоцистоза
Sarcocystis hominis (bovihominis)
13. Toxoplasma gondii — токсоплазмоза
Гельминты
III группа
1. Echinococcus multilocularis — альвеолярного эхинококкоза
2. Echinococcus granulosus — гидатидозного эхинококкоза
3. Trichinella spp. — трихинеллеза
IV группа
1. Ancylostoma duodenale — анкилостомоза
2. Anisakis spp. — анизакиаза
3. Askaris lumbricoides — аскаридоза человека
Askaris suum
4. Clonorchis sinensis — клонорхоза
5. Dicrocoelium lanceatum — дикроцелиоза
6. Dioctophyme renale — диоктофимоза
7. Diphyllobotrium latum — дифиллоботриоза
Diphyllobotrium luxi
Diphyllobotrium dendriticum
8. Dipylidium caninum — дипилидиоза
9. Dirofilaria repens — дирофиляриоза
Dirofilaria immitis
10. Dracunculus medinensis — дракункулеза (ришты)
11. Enterobius vermicularis — энтеробиоза
12. Fasciola hepatica — фасциолеза
Fasciola gigantica
13. Fasciolopsis buski — фасциолопсидоза
14. Hymenolepis nana — гименолепидоза
Hymenolepis diminuta
15. Loa loa — лоаоза
16. Methagonimus jokogowai — метагонимоза
17. Multiceps multiceps — ценуроза
18. Nanophyetes schikhobalowi — нанофиетоза
19. Necator americanus — некатороза
20. Opisthorchis felineus — описторхоза
Opisthorchis viverini
21. Paragonimus westermani — парагонимоза
22. Pseudamphistomum truncatum — псевдофистомоза
23. Sparganum — спарганоза
24. Schistosoma haematobium — шистосомоза мочеполового
25. Schistosoma mansoni — шистосомоза кишечного
Schistosoma japonicum
Schistosoma intercalatum
26. Strongyloides stercoralis — стронгилоидоза
27. Taenia solium — тениоза
28. Taeniarinchus saginatus — тениаринхоза
29. Toxocara canis — токсокароза
Toxocara mystax
Toxocara leonina
30. Trichocephalus trichiurus — трихоцефалеза
Членистоногие
III группа
1. Sarcoptes scabiei — чесотки
IV группа
1. Demodex folliculorum — демодекоза
2. Pediculus capitis — педикулеза
Pediculus vestimenti
3. Phthirus pubis — фтириаза
4. Клещи домашней пыли — аллергии (астматический бронхит, бронхиальная астма)
5. Ornithonyssus bacoty — крысиного клещевого дерматита
Яды биологического происхождения
II группа
1. Ботулинические токсины всех типов
2. Холерный токсин
3. Столбнячный токсин
III группа
1. Микотоксины — микотоксикозы
2. Дифтерийный токсин
3. Стрептококковый токсин группы А
Примечание:
1. Аттенуированные штаммы возбудителей I-II групп относят к микроорганизмам III группы патогенности. Аттенуированные штаммы III-IV групп относят к IV группе патогенности.
2. По мере открытия новых возбудителей инфекционных болезней списки будут дополняться.

Оставить заявку
Оставьте свои контактные данные и наш менеджер свяжется с вами в ближайшее время и проведет бесплатную консультацию
Ваша заявка принята. Скоро наш менеджер свяжется с Вами.
